
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
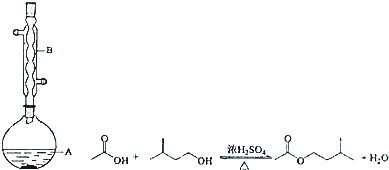
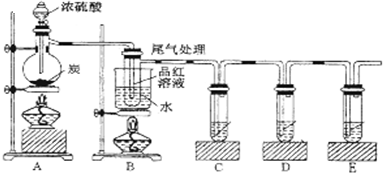
分析 在装置A中加入反应混合物和2~3片碎瓷片,开始缓慢加热A,利用冷凝管冷凝回流50分钟,反应液冷至室温后,倒入分液漏斗中,先用少量水洗掉大部分硫酸和醋酸,再用水洗涤碳酸氢钠溶液,分出的产物加入少量无水硫酸镁固体作干燥剂,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯,
(1)仪器B的构造判断该仪器的名称,位于烧瓶上方起到的作用是冷凝回流,原料充分利用;
(2)混合溶液加热为防止暴沸需要添加碎瓷片;
(3)反应后A中有乙酸异戊酯,乙酸,异戊醇,浓硫酸及碎瓷片,所以第一次水洗反应液洗去大部分乙酸和硫酸,分液后再用饱和碳酸氢钠溶液洗去酸,分液后再用水洗去碳酸氢钠等盐;
(4)根据乙酸异戊酯的密度及正确的分液操作方法进行解答;
(5)少量无水硫酸镁能够吸收乙酸异戊酯中少量的水分,起到干燥作用;
(6)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计算出产率,产率=$\frac{实际量}{理论量}$×100%.
解答 解:(1)由装置中仪器B的构造可知,仪器B的名称为冷凝管或球形冷凝管,作用是 冷凝回流,使反应物充分利用,
故答案为:冷凝管或球形冷凝管; 冷凝回流,使反应物充分利用;
(2)混合溶液加热为防止暴沸需要添加碎瓷片,
故答案为:防暴沸;
(3)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第一步中饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,但第一步洗涤后生成的酯中混有碳酸氢钠,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠,
故答案为:洗掉大部分硫酸和醋酸;洗掉碳酸氢钠;
(4)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d,
故答案为:d;
(5)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥,
故答案为:干燥乙酸异戊酯;
(6)乙酸的物质的量为:n=$\frac{6.0g}{60g/mol}$=0.1mol,异戊醇的物质的量为:n=$\frac{4.4g}{88g/mol}$=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为=$\frac{3.9g}{130g/mol}$=0.03mol,所以实验中乙酸异戊酯的产率为:$\frac{0.03mol}{0.05mol}$×100%=60%,
故答案为:d.
点评 本题考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、药品的选择及使用、物质产率的计算等知识,题目难度中等,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力及灵活应用所学知识的能力.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正逆反应速率都增大 | |
| B. | 平衡不移动 | |
| C. | 再次平衡时c(D) 不变 | |
| D. | C的体积分数不再变化说明再次达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| B. | 化学反应速率为“0.8mol/(L•min)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L | |
| C. | 化学反应达到平衡状态,反应停止 | |
| D. | 化学反应速率是定量描述化学反应快慢的物理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学方程式 | K(t1) | K(t2) | |
| ① | Br2 (g)+H2(g)?2HBr(g) | 5.6×107 | 9.3×106 |
| ② | I2 (g)+H2 (g)?2HI(g) | 43 | 34 |
| A. | ①和②均是放热反应 | |
| B. | 相同条件下,平衡体系中HX所占的比例:①>② | |
| C. | 其他条件不变时,增大压强可提高X2的平衡转化率 | |
| D. | 其他条件不变时,升高温度可加快HX的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用该反应进行人工固氮 | |
| B. | 将3mol N2(g)和3mol H2(g)混合,在高温、高压和催化条件下充分反应,放出热量92.22kJ | |
| C. | 因为反应需要加热,所以反应放出热量 | |
| D. | 其他条件相同时,采用更高效的正催化剂,既能提高反应速率,又能增大反应放热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H+(aq)+OH- (aq)=H2O(l)△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)=H2O(l)△H=-44.0kJ•mol-1可知是放热反应; | |
| C. | 由SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 氢气的燃烧热(△H)为-285.5kJ/mo1,则水电解的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5KJ/mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)═C(金刚石)△H=1.9 kJ•mol”可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol,若将含1 mol H2SO4与含2 mol NaOH的溶液混合,放出的热量等于114.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com