
| A、HCO3- |
| B、Na+ |
| C、Ba2+ |
| D、NO3- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 ,生产过程如图:
,生产过程如图:
 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B、常温下,等物质的量浓度的 (NH4)2CO3 和Na2CO3溶液,前者的c(HCO3-)小 |
| C、NaHCO3溶液中离子浓度有如下关系:c(CO32-)+c (OH-)=c (H+)+c(H2CO3) |
| D、等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
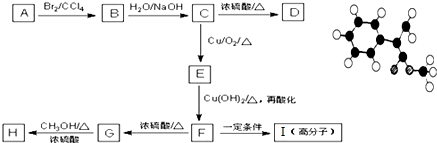
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| B、测定某无色溶液的pH值时:用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 |
| C、滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 |
| D、向某待测液中加入氢氧化钠并加热,将湿润的蓝色石蕊试纸靠近若变红,说明原溶液有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,
在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cu2+、Cl-、SO42- |
| B、HCO3-、NO3-、SO42-、Na+ |
| C、Cl-、SO42-、K+、Na+ |
| D、Na+、SO42-、Cl-、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com