
| A、Na2S溶液的水解:S2-+2H2O?H2S+2OH- | |||
| B、NaHCO3溶液的电离:HCO3-+H2O?CO32-+H3O+ | |||
| C、NH4Cl溶液的水解:NH4++H2O?NH3?H2O+H+ | |||
D、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
|


科目:高中化学 来源: 题型:
| A、其他条件不变,温度的升高,纯水的pH不变 |
| B、其他条件不变,加水稀释后,碳酸钠溶液的c(H+)减小 |
| C、其他条件不变,温度的升高,碳酸溶液的c(H+)基本不变 |
| D、其他条件不变,常温pH=5的盐酸稀释1000倍后,溶液的pH变为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有机物A可发生如下转化:
有机物A可发生如下转化:查看答案和解析>>
科目:高中化学 来源: 题型:
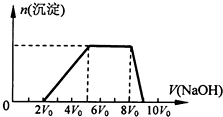 某混合溶液中可能含有的离子如表所示:
某混合溶液中可能含有的离子如表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu
纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ | Al3+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 | 3.7 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 | 4.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
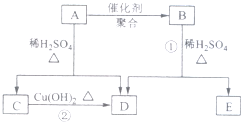 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如下图所示:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如下图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com