
完成下列反应的反应方程式:
(1)NaOH溶液吸收氯气的反应:____________________________
(2)铁与水蒸气在高温下的反应: ____________________________
(3)氢氧化铁溶于盐酸:____________________________
(4)铝单质溶解在氢氧化钠溶液中:____________________________
(5)过氧化钠与二氧化碳反应:____________________________
科目:高中化学 来源:2016届重庆市高三上学期10月月考理综化学试卷(解析版) 题型:选择题
PbO2受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为1:1,则剩余固体的组成及物质的量比可能是
A.1:2:1混合的PbO2、Pb3O4、PbO
B.1:3:2混合的PbO2、Pb3O4、PbO
C.1:1:1混合的PbO2、Pb3O4、PbO
D.2:1:1混合的PbO2、Pb3O4、PbO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中选修化学试卷(解析版) 题型:填空题
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。
已知:碳化反应是放热反应,化学方程式Ca(OH)2+Mg(OH)2+3CO2 CaCO3+Mg(HCO3)2+H2O。完成下列填空:
CaCO3+Mg(HCO3)2+H2O。完成下列填空:
(1)Ca(OH)2的碱性比Mg(OH)2的碱性 (填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (填“大”或“小”)。
(2)碳化温度保持在50~60 ℃。温度偏高不利于碳化反应,原因是 、 (至少写2点)。温度偏低也不利于碳化反应,原因是 。
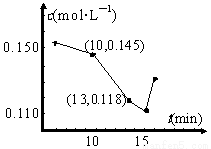
(3)已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10 min到13 min之内钙离子的反应速率为 。用化学方程式表示15 min之后钙离子浓度增大的原因 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上第一次月考化学试卷(解析版) 题型:实验题
(10分)用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
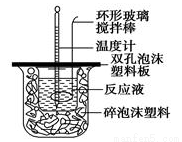
(1)烧杯间填满碎泡沫塑料的作用是 ;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替? (填“能”或“不能”),其原因是 ;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_______________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量 (填“相等”“不相等”),若实验操作均正确,则所求中和热 (填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
某溶液中含有大量的Cl-、CO32-、OH-等三种离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是
(1)滴加Mg(NO3)2溶液;(2)过滤;(3)滴加AgNO3溶液;(4)滴加Ba(NO3)2溶液
A.(1)(2)(4)(2)(3) B.(4)(2)(1)(2)(3)
C.(1)(2)(3)(2)(4) D.(4)(2)(3)(2)(1)
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
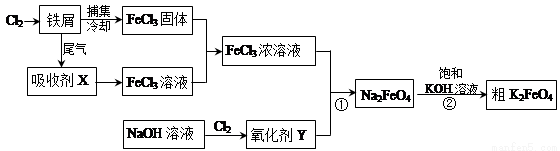
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;(2分)
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板_________________________。(2分)
(2)吸收剂X的化学式为 ;(1分)氧化剂Y的化学式为____________。(1分)
(3)碱性条件下反应①的离子方程式为____________________________________。(2分)
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_____ 。(2分)
(5)K2FeO4 在水溶液中易发生反应:4FeO42+10H2O 4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。(2分)
4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。(2分)
A.H2O
B.稀KOH溶液、异丙醇
C.NH4Cl溶液、异丙醇
D.Fe(NO3)3溶液、异丙醇
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O CrO42-+Fe(OH)3↓+OH-
CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。(2分)
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰市宁城县高三上学期第一次统考化学试卷(解析版) 题型:选择题
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法不正确的是
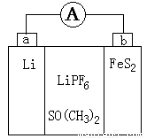
A.可以用水代替SO(CH3)2做溶剂
B.电子移动方向是由a极流向b极
C.该装置将化学能转化为电能
D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上学期第一次月考化学试卷(解析版) 题型:填空题
(1)当O2和CO2的质量之比为1:1时,物质的量之比为 : ,原子总数之比为: , 在同温同压下,密度之比为: ;在三个同温同体积的容器中,分别充入等质量的①H2②CO2③O2三种气体,则容器内压强由大到小的顺序为: ,若将O2和CO2按物质的量之比为2:3混合,则混合气体的平均相对分子质量为: 。
(2)标准状况下,V L某气体(相对分子质量为M)溶解在a L水中(水的密度近似为1 g/mL),所得溶液的密度为ρg/mL,则溶质的质量分数为: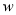 = ,溶质的物质的量浓度:c= mol/L。
= ,溶质的物质的量浓度:c= mol/L。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上期中测试化学试卷(解析版) 题型:选择题
下列关于物质的量浓度表述正确的是
A.0.2mol·L-1Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B.50mL2mol·L-1NaCl溶液和100mL0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1L水吸收22.4L氯化氢所得盐酸的浓度是1mol·L-1
D.10g98%的硫酸(密度为1.84g·cm—3)与10mL18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com