
【题目】已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体, D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。各物质之间的转换关系如下图,部分生成物省略。请回答下列问题:
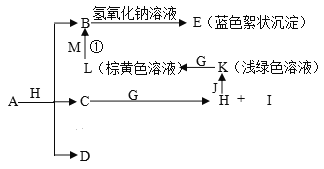
(1)写出A的化学式__________________,C的电子式______________________,
D的结构式______________________________。
(2)将22.4L(标准状况)D气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中除了Na+外,还大量存在的离子是______________________________。
(3)已知M溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式___________________________________________________________。
(4)检验化合物K中阳离子的实验方法是______________________________________
(5)写出反应K+G→L的化学方程式是________________________________________。
【答案】 CuCO3或Cu2(OH)2CO3 ![]() O=C=O HCO3- 3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O 向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有Fe2+存在 2Fe2++Cl2===2Fe3++2Cl-
O=C=O HCO3- 3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O 向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有Fe2+存在 2Fe2++Cl2===2Fe3++2Cl-
【解析】X在周期表中的原子半径最小,则X为H元素;Y、Z原子最外层电子数之和为10,X、Y、Z的原子序数依次增大,C、D是由X、Y、Z中两种元素组成的化合物,D为无色非可燃性气体,考虑Y、Z为C、O两种元素,C通常状况下为无色液体,则D为CO2,C为H2O;G为黄绿色单质气体,则G应为Cl2,由C+G→H+I,可以知道生成HCl和HClO,I有漂白作用,应为HClO,则H为HCl,浅绿色、棕黄色溶液为Fe2+和Fe3+,可以知道J为Fe,K为FeCl2,L为FeCl3,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,B为CuCl2,B与氢氧化钠反应生成蓝色絮状沉淀,则E为Cu(OH)2,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可以知道,A是含有Cu2+的碳酸盐,应为CuCO3或Cu2(OH)2CO3。
(1)根据上面的分析可以知道,A为CuCO3或Cu2(OH)2CO3,C为H2O,C的电子式为![]() ,D为CO2,D的结构式为O=C=O;正确答案:CuCO3或Cu2(OH)2CO3;
,D为CO2,D的结构式为O=C=O;正确答案:CuCO3或Cu2(OH)2CO3;![]() ;O=C=O。
;O=C=O。
(2)将22.4L(标准状况)CO2气体通入1L 1mol/L NaOH溶液中,完全吸收后恰好完全反应生成溶液为NaHCO3溶液,溶液除了Na+外,还大量存在的离子是HCO3-;正确答案是:HCO3-。
((3)已知M为铜,与稀硝酸反应,溶液变成蓝色,生成硝酸铜,并放出无色气体一氧化氮;反应的离子方程式为3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O ;正确答案:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O 。
(4)检验亚铁离子,可向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有![]() 存在;正确答案:向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有Fe2+存在。
存在;正确答案:向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有Fe2+存在。
(5)![]() →L为氯气和氯化亚铁反应生成氯化铁的反应,离子方程式为2Fe2++Cl2==2Fe3++2Cl-;正确答案:2Fe2++Cl2===2Fe3++2Cl-。
→L为氯气和氯化亚铁反应生成氯化铁的反应,离子方程式为2Fe2++Cl2==2Fe3++2Cl-;正确答案:2Fe2++Cl2===2Fe3++2Cl-。


科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的气体,用于生产多种化工产品。该技术中的化学反应为:CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH=+330kJ/mol
2H2O(g)+4CO(g) ΔH=+330kJ/mol
(1)下图表示初始投料比n(CH4):n(CO2)为1:3或1:4,CH4的转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用a1、a2表示]

①a2=__________。
②判断T1的T2的大小关系,并说明理由:__________。
(2)CH4超干重整CO2的催化转化原理示意图如下:

①过程Ⅰ,生成1mol H2时吸收123.5kJ热量,其热化学方程式是__________。
②过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是__________。
③假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是__________。(填序号)
a.过程Ⅰ和过程Ⅱ中发生了氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料![]() ,可导致过程Ⅱ中催化剂失效
,可导致过程Ⅱ中催化剂失效
【答案】 1:4 T2>T1 正反应为吸热反应,温度升高时甲烷的转化率增大 CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol 4H2+Fe3O4![]() 3Fe+4H2O ac
3Fe+4H2O ac
【解析】(1). ①.在相同条件下,投料比越小,甲烷的转化率越大,据图可知,a2>a1,故a2表示的是1:4时甲烷的转化率,故答案为:1:4;
②. 因CH4(g)+3CO2(g)![]() 2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
(2). ①.在过程I中,生成1mol H2时吸收123.5kJ热量,据图可知,其热化学方程式为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol;
②. 由过程II的转化关系来看,混合气体中的H2将Fe3O4还原为Fe,反应方程式为:4H2+Fe3O4 ![]() 3Fe+4H2O,故答案为:4H2+Fe3O4
3Fe+4H2O,故答案为:4H2+Fe3O4 ![]() 3Fe+4H2O;
3Fe+4H2O;
③. a. 两个过程都有元素化合价的改变,都发生了氧化还原反应,故a正确;b. 过程II中Fe3O4最终被还原为Fe,Fe3O4不是催化剂,故b错误;c. 若初始投料比![]() 时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。
时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。
【题型】综合题
【结束】
17
【题目】工、农业废水以及生活污水中浓度较高的![]() 会造成氮污染。工业上处理水体中
会造成氮污染。工业上处理水体中![]() 的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
(1)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
①除锈反应的离子反程式是__________。
②判断铁屑洗净的方法是__________。
(2)将KNO3溶液的pH调至2.5。从氧化还原的角度分析调低溶液pH的原因是__________。
(3)将上述处理过的足量铁屑投入(2)的溶液中。如图表示该反应过程中,体系内相关离子浓度、pH随时间变化的关系。请根据图中信息回答:

①t1时刻前该反应的离子方程式是__________。
②t2时刻后,该反应仍在进行,溶液中![]() 的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
(4)铁屑与KNO3溶液反应过程中向溶液中加入炭粉,可以增大该反应的速率,提高![]() 的去除效果,其原因是__________。
的去除效果,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元索形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_____________ (用元素符号表示,下同)。
(2)写出W的价电子排布式__________________________,W同周期的元素中,与W原子最外层电子数相等的元素还有_____________。
(3)X、Y、Z的简单氢化物的键角从大到小的顺序是__________________________(用化学式表示),原因是__________________________。
(4)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_____________,该物质硬度大,推测该物质为_____________晶体。其中Y元素的杂化方式是_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出四种元素的名称:A________B_______C__________D_________
(2)用电子式表示化合物A2B的形成过程:______________________。
(3)写出D元素形成的单质的结构式:__________________________。
(4)A、B两种元素组成的化合物A2B2存在的化学键是________________。
(5)写出下列物质的电子式:E与B形成的化合物__________________;A、B、E形成的化合物_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铜片、锌片和200 mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:
(1)反应中消耗的锌的质量是多少______?
(2)有多少个电子通过了导线______?
(3)原稀H2SO4的物质的量浓度是多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论错误的是( )
实验 | 实验现象 | 结论 |
A |
| 活动性:Al>Fe>Cu |
B |
| 铜与浓硝酸的反应产物是NO |
C |
| 增大反应物浓度,平衡向正反应方向移动 |
D |
| 装置气密性良好 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶,F是用于鼓入空气的打气球。

(1)实验时,第一步实验操作为:将装有CaCO3干燥管下移与稀硝酸反应生成CO2,该操作的作用是_____。
(2)第二步,提起干燥管B,将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为________。有人认为E中收集到的可能是H2而不是NO,如何证明?_______________。
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。请指出不当之处是__________。
(4)将一支试管中充入20mLNO2和O2的混合气体,倒扣在水槽中,待反应停止后,试管内剩余2mL无色气体。则原混合气体中NO2的体积是______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是
A.H2(g)+Br2(g)![]() 2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) ![]() N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s) ![]() CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变
CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变
D.3H2(g)+N2(g) ![]() 2NH3(g) 反应体系中H2与N2的物质的量之比保持3∶1
2NH3(g) 反应体系中H2与N2的物质的量之比保持3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00molL﹣1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100molL﹣1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00mlL﹣1盐酸恰好完全中和.计算:
(1)混合物中Na2SO4的质量;
(2)混合物中Na2CO3的物质的量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com