
A. ![]() (
(![]() )=0.010 mol·L-1·s-1 B.
)=0.010 mol·L-1·s-1 B. ![]() (
(![]() )=0.0010 mol·L-1·s-1
)=0.0010 mol·L-1·s-1
C. ![]() (NO)=0.0010 mol·L-1·s-1 D.
(NO)=0.0010 mol·L-1·s-1 D.
![]() (
(![]() )=0.045 mol·L-1·s-1
)=0.045 mol·L-1·s-1
科目:高中化学 来源: 题型:013
反应![]() (g)+X
(g)+X![]() (g)
(g) ![]() 4NO(g)+
4NO(g)+![]() (g)在10
L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均速率
(g)在10
L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均速率![]() (反应物的消耗速率或产物的生成速率)可表示为( )
(反应物的消耗速率或产物的生成速率)可表示为( )
A. ![]() (
(![]() )=0.010 mol·L-1·s-1 B.
)=0.010 mol·L-1·s-1 B. ![]() (
(![]() )=0.0010 mol·L-1·s-1
)=0.0010 mol·L-1·s-1
C. ![]() (NO)=0.0010 mol·L-1·s-1 D.
(NO)=0.0010 mol·L-1·s-1 D.
![]() (
(![]() )=0.045 mol·L-1·s-1
)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西师大附中、鹰潭一中高三理综联考化学试卷(解析版) 题型:计算题
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g) 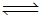 CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g)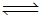 2CO(g)
△H=+172.5kJ•mol-1
2CO(g)
△H=+172.5kJ•mol-1
则CO(g)+H2O(g)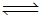 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)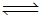 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
若用该电池提供的电能电解60mL NaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
 CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
|
温度/℃ |
起始量/mol |
平衡量/mol[学科 |
达到平衡所x需时间/min |
||
|
H2O |
CO |
H2 |
CO |
||
|
900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)
 2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。
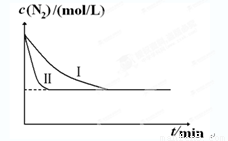

图1 图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省高三五校联谊模拟考试(理综)化学部分 题型:填空题
相同温度下,在四个密闭容器中发生可逆反应:H2(g)+I2(g) 2HI(g),实验测得起始、平衡时的有关数据如下表所示:
2HI(g),实验测得起始、平衡时的有关数据如下表所示:
|
容器编号[来源:学_科_网] |
起始时各物质的物质的量(mol)[来源:ZXXK][来源:学_科_网Z_X_X_K][来源:学|科|网] |
达平衡时体系的变化[来源:学+科+网Z+X+X+K] |
||
|
I2 |
H2 |
HI |
||
|
① |
1 |
3 |
0 |
放出热量:Q1=23.15kJ |
|
② |
0.8 |
2.8 |
0.4 |
平衡时碘化氢的体积分数为20% |
|
③ |
0 |
4 |
4 |
|
|
④ |
2 |
3 |
0 |
|
(1)下列叙述正确的是
A.四个容器中反应的平衡常数相等
B.反应的热化学方程式为:H2(g)+I2(g) 2HI(g) △ H =23.15kJ/mol
2HI(g) △ H =23.15kJ/mol
C.平衡时,容器④中H2的转化率高于① D、容器②中达平衡时放出的热量Q2<23.15kJ
E、达到平衡后若将容器①的体积变为0.25 L,H2的转化率提高
(2)该温度下,在容积为1L密闭容器③中发生反应建立平衡,若达到平衡所需的时间为2min,则平均反应速率v(HI)= ,该温度下,反应H2(g)+I2(g) 2HI(g)的平衡常数 K=
。
2HI(g)的平衡常数 K=
。
(3)平衡常数K只受温度的影响,与浓度、压强等因素无关,故可利用平衡常数来判断平衡是否移动及移动的方向。例如,若③为一个装有可移动活塞的容器,上述平衡达成后用外力将活塞向内推至容积为0.5L并恢复原温度,则由于
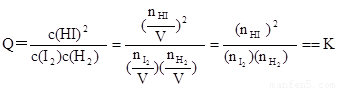 ,
,
可判断平衡将 (填“正向”、“逆向”或“不”)移动。
(4)如果保持温度和压强不变,向③的平衡体系中加入1.6molI2,平衡将 (填“正向”、“逆向”或“不”)移动,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) ![]() 3NH3(g) △H=-92.2kJ?mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
3NH3(g) △H=-92.2kJ?mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
催化剂:铁触媒,温度400℃~500℃,压强:30MPa~50MPa。
回答下列问题:
(1) 合成氨工业中原料气压缩到30MPa~50MPa的原因是
;从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400℃~500℃的高温,原因是
。
(2)500℃、50MPa时,在容积为1L的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
(3)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2。已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ?mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ?mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃烧电池。请写出该电池的正极反应式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热,等等.
(1)下列ΔH表示物质燃烧热的是________;表示物质中和热的是________.(填ΔH1、ΔH2 和ΔH3等)
A.2H2(g)+O2(g)=2H2O(l) ΔH1;
B.C(s)+1/2O2(g)=CO(g) ΔH2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH3;
D.C(s)+O2(g)=CO2(g) ΔH4;
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l); ΔH7
(2)2.00gC2H2气体完全燃烧生成液态水和CO2,放出99.6 kJ的热量.写出该反应的热化学方程式: 。
(3)充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与5 mol/L100mL KOH溶液完全反应.求燃烧1 mol丁烷放出的热量(设其数值为X) 。
(4)碳和碳的化合物在生产、生活中的应用非常广泛,“低碳生活”已成潮流,清洁能源的开发、煤的综合利用等是实现“低碳生活”的重要途径。甲烷是一种重要的清洁燃料,燃烧放出大量的热,可直接作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= —1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2= —566 kJ/mol
则表示甲烷燃烧热的热化学方程式 ;
请从化学反应的本质解释甲烷燃烧放出热量的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com