
A.Na2CO3溶液 B.水 C.K2SO4溶液 D.CaO粉末
科目:高中化学 来源:导学大课堂必修二化学鲁科版 鲁科版 题型:021
|
足量的Zn粉与100 mL 6.0 mol·L-1的硫酸溶液反应,为了减缓反应进行的速率,但又不影响生成H2的总量,可向硫酸溶液中加入适量的 | |
A. |
Na2CO3溶液 |
B. |
水 |
C. |
K2SO4溶液 |
D. |
CaO粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知25℃时几种物质(溶液浓度为0.1mol/L)的电离度如下表:(电离度:弱电解质已电离的分子的物质的量占分子总物质的量的百分数)(已知:H2SO4的第一步电离是完全的)
| ①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl |
| 10% | 29% | 1.33% | 100% |
i25℃时,0.1mol/L上述几种溶液c(H+)由大到小的顺序是(填序号) .
ii25℃时,将足量的Zn粉放入等体积、pH=1的上述几种溶液中,产生氢气的体积(同温同压下)由大到小的顺序是(填序号) .
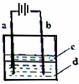 (2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
i a电极材料为 ,其电极反应式为 ;
电解过程中,b极附近溶液pH= (增大、减小、不变),
试用必要的文字说明原因 。
ii d电解液是 时,电解片刻后,装置中可见Fe(OH)2白色沉淀。
A.稀硫酸 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
iii 装置中液体c的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com