
下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<O
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生诱,而镀锡铁则相反
C.对于N2(g)+3H2(g) 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
D.电解NaCl或制取Na或Al
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝与盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 碘化钾溶液中滴入溴水:2I-+Br2═I2+2Br- | |
| D. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+3OH-═AlO2-+3H2O |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
向含amolFeCl2的溶液中加入含bmolBr2的溴水,充分反应。下列说法不正确的是
A.离子的还原性强弱:I- >Fe2+ >Br-
B.当a≥b时,发生的离子反应:2I-+ Br2= I2+2Br-
C.当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=2Fe3++I2+4Br-
D.当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:实验题
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。

【背景素材】
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO3-, MnO4-被还原成Mn2+
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1)装置A三颈烧瓶中发生反应的化学方程式为_______________________。
(2)B装置的目的是①________________②_____________。
(3)E装置的作用是 。
【测定NaNO2纯度】
(4)本小题可供选择的试剂有:
A.稀硫酸
B.c1mol/LKI溶液
C.淀粉溶液
D.c2mol/LNa2S2O3溶液
E.c3mol/L酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
B.水电离出的c(H+)=1×10-4mol/L的溶液中:Ba2+、NO3-、K+、SO32-
C.使苯酚显紫色的溶液中:NH4+、Na+、Cl-、SCN-
D.使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列有关氮元索及其化合物的表示正确的是
A. 质子数为7、中子数为7的氮原子:147N
B. 氮原子的结构示意图:
C. 氨气分子的电子式:
D. 对硝基甲苯的结构简式: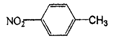
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
由C16O和C18O组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是
A.混合气体中C16O与C18O的分子数之比为14:15
B.混合气体中C16O与C18O的物质的量之比为1:1
C.混合气体中C16O与C18O的质量之比为15:14
D.混合气体中C16O与C18O的密度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

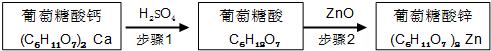
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备 1,2-二溴乙烷的反应原理如下:
实验室制备 1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com