
| A. | 100 mL | B. | 500 mL | C. | 1000 mL | D. | 1500 mL |
分析 加入2mol/L的氢氧化钠溶液,要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶液为氯化钠溶液,根据钠离子与氯离子守恒计算氢氧化钠的物质的量,进而计算所需体积.
解答 解:要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶液为氯化钠溶液,根据钠离子与氯离子守恒可知:n(NaOH)=n(NaCl)=n(HCl)=0.5L×4mol/L=2mol,
所以需氢氧化钠溶液的体积为$\frac{2mol}{2mol/L}$=1L=1000mL,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,明确酸碱恰好中和时沉淀质量最大及氢氧化铝能溶于强碱时解答本题的关键,试题充分考查了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He原子核内含有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核内含有3个质子 | |
| C. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | CO2(SO2) | 饱和NaHCO3溶液 | 洗气 |
| B | BaCO3(BaSO4) | 饱和Na2CO3溶液 | 搅拌、过滤 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | Cl2(HCl) | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
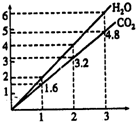 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )| A. | 一定含有CH4 | B. | 一定含有C2H6 | C. | 一定含有C2H4 | D. | 一定不含有C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化钠溶液 | B. | 碳酸钠溶液 | C. | 浓硫酸 | D. | 饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学在实验室研究SO2的性质(夹持装置省略,装置内的空气已排除)
某同学在实验室研究SO2的性质(夹持装置省略,装置内的空气已排除)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com