
| A. | ⑧⑨⑩ | B. | ⑦⑧⑨ | C. | ③⑦⑩ | D. | ⑦⑧⑩ |
分析 为加快铁与盐酸的反应速率,可增大浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答.
解答 解:①加H2O,浓度降低,反应速率减小,故错误;
②加NaOH固体,盐酸浓度降低,反应速率减小,故错误;
③加CH3COONa固体,生成弱酸,氢离子浓度降低,反应速率减小,故错误;
④加Na2CO3固体,消耗盐酸,改变H2的产量,故错误;
⑤加入NaNO3固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气,故错误;
⑥加NaCl溶液,溶液浓度降低,反应速率减小,故错误;
⑦滴加几滴硫酸铜溶液,生成铜,形成原电池反应,加快反应速率,故正确;
⑧升高温度(不考虑盐酸挥发),反应速率增大,故正确;
⑨将块状铁改为铁粉,固体表面积增大,反应速率增大,故正确;
⑩将稀硫酸改用98%的浓硫酸,与铁反应不发生氢气,故错误.
故选B.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,本题不改变生成氢气总量的要求,答题时注意审题,难度不大.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 酒精含有的分子数为NA | |
| B. | 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积约为22.4 L | |
| D. | 通常状况下,71 g Cl2所含原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
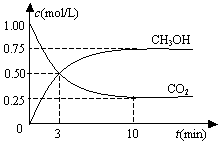 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol| A. | 反应进行到3 min时,该反应达到平衡状态 | |
| B. | 从反应开始到平衡,CO2的转化率为25% | |
| C. | 第3 min时,氢气的平均反应速率为1.5mol/(L•min) | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3发生还原反应 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | 每生成1 mol ClO2,转移的电子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
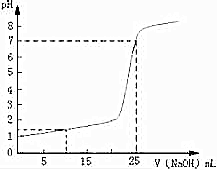 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com