

分析 根据电解池的工作原理,电解第一阶段:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu↓+O2↑+2H2SO4,第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,出多少加多少,根据电子守恒以及元素守恒进行计算.
解答 解:根据电解池的工作原理,第一阶段:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu↓+O2↑+2H2SO4,第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,根据图示数据,开始阶段产生的是1.12L即0.05mol的氧气,根据反应得到电解产生的金属铜的物质的量是0.1mol,这些金属铜全部来自硫酸铜,原CuSO4溶液浓度c(CuSO4)=$\frac{0.1mol}{0.5L}$=0.2mol/L,开始阶段产生的是1.12L即0.05mol的氧气,此时转移电子是0.2mol,当产生4.48L气体时,第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,氢气和氧气按照物质的量是2:1产生的,总共是3.36L,即0.15mol,0.1mol的氢气和0.05mol的氧气,该过程消耗水,根据铜元素守恒以及让电解后的电解质复原,则遵循的原则是:出什么加什么,出多少加多少,应该是加入Cu(OH)20.1mol,质量是9.8g,故答案为:0.2; 9.8.
点评 本题考查学生电解池的工作原理知识,要求学生具有分析和解决问题的能力,难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 与Fe反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
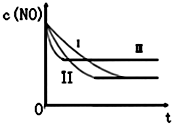 汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁燃烧发出耀眼的白光,可用来制造信号弹和焰火 | |
| B. | 碳酸氢钠能与酸反应,可用来治疗胃酸过多 | |
| C. | 利用铜与氯化铁溶液的反应来制作印刷电路板 | |
| D. | 铝制品表面有致密的氧化膜保护层,可长时间盛放咸菜等腌制食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
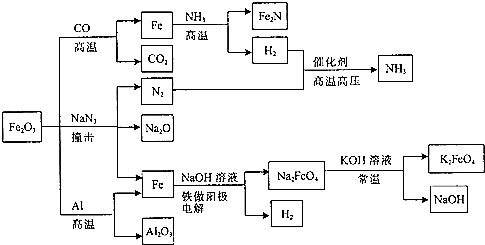
| A. | Fe2O3与Al的反应属于吸热反应 | |
| B. | Fe2O3与NaN3反应,每消耗1molFe2O3产生9molN2 | |
| C. | Fe2O3与CO的反应属于置换反应 | |
| D. | 常温下K2FeO4在水中的溶解度比Na2FeO4的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | Na2CO3溶液中CO32-的水解:CO32-+H2O═HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
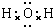 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
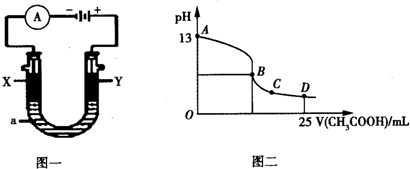
 某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com