
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离常数 (25℃) | Ki=1.77×10-4 | Kii=2.98×10-6 | K1Ki1=4.3×10-7 Ki2=5.6×10-11 | Ki1=1.54×10-2 Ki2=5.6×10-7 |
分析 (1)从平衡常数知,HCOOH的Ki=1.77×10-4,HClO的Kii=2.98×10-6,甲酸的电离常数比次氯酸大,故酸性强于次氯酸;
(2)根据碳酸钠的两级电离常数知Ki2=5.6×10-11<Ki2=5.6×10-7,故还有NaHCO3、NaClO;
(3)根据数据知,亚硫酸酸性比碳酸强,故向一定量的NaHCO3(aq)中通入少量的SO2(g),反应的离子方程式为HCO3-+SO2→HSO3-+CO2;(4)Se的化合价有+3升高到+4,Mn的化合价有+7降低到+2,根据化合价升降守恒和原子守恒,配平的方程式为:5H2SeO3+2KMnO4→K2SeO4+2MnSeO4+2H2SeO4+3H2O,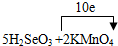 ;
;
(5)元素非金属性越强,最高价氧化物的水化物的酸性越强,向碲酸中通入SO2气体,若反应中生成的TeO2与Te的物质的量之比为2:1,该反应的化学方程式为5SO2+3H6TeO6→2TeO2+Te+5H2SO4+4H2O;当6mol碲酸与一定量SO2恰好完全反应,所得溶液体积为20L,产生10mol硫酸,氢离子的物质的量为20mol,氢离子浓度为1mol/L,pH=pH=lgc(H+).
解答 解:(1)从平衡常数知,HCOOH的Ki=1.77×10-4,HClO的Kii=2.98×10-6,甲酸的电离常数比次氯酸大,故酸性强于次氯酸,对应的盐的碱性弱于次氯酸钠,故答案为:NaClO(aq);
(2)1molCl2与2molNa2CO3(aq)反应除生成NaCl外还有,根据碳酸钠的两级电离常数知,还有NaHCO3、NaClO,故答案为:NaHCO3、NaClO;
(3)根据数据知,亚硫酸酸性比碳酸强,故向一定量的NaHCO3(aq)中通入少量的SO2(g),反应的离子方程式为HCO3-+SO2→HSO3-+CO2↑,故答案为:HCO3-+SO2→HSO3-+CO2↑;
(4)Se的化合价有+3升高到+4,Mn的化合价有+7降低到+2,根据化合价升降守恒和原子守恒,配平的方程式为:5H2SeO3+2KMnO4→K2SeO4+2MnSeO4+2H2SeO4+3H2O,故答案为:5、2、1、2、2、3H2O;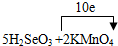 ;
;
(5)元素非金属性越强,最高价氧化物的水化物的酸性越强,非金属性Te<S,故(H6TeO6)的酸性比H2SO4弱,向碲酸中通入SO2气体,若反应中生成的TeO2与Te的物质的量之比为2:1,该反应的化学方程式为5SO2+3H6TeO6→2TeO2+Te+5H2SO4+4H2O;当6mol碲酸与一定量SO2恰好完全反应,所得溶液体积为20L,产生10mol硫酸,氢离子的物质的量为20mol,氢离子浓度为1mol/L,pH=lgc(H+)=0,故答案为:弱;5SO2+3H6TeO6→2TeO2+Te+5H2SO4+4H2O;0.
点评 本题考查了氧化还原方程式的配平方法、电子转移情况、电离平衡常数的应用,难度较大,需要非常扎实的基础才能顺利解决.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸不能将Fe氧化为Fe3+ |
| B | NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-与HCO3-发生双水解反应 |
| C | 向某溶液里滴加稀NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变 | 原溶液中无NH4+ |
| D | 将0.1mol•L-1MgSO4溶液滴入到NaOH溶液里至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的Ksp小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
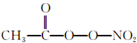 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
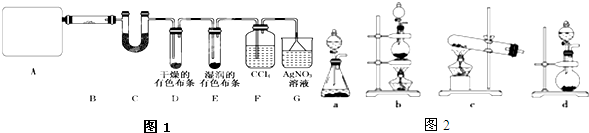
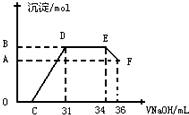
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
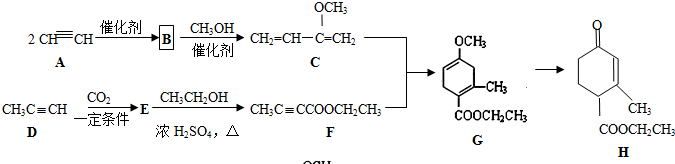
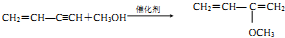 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(A) | n(B) | n(C) | ||
| ① | 700 | 4.0 | 1.0 | 1.80 |
| ② | 800 | 1.0 | 4.0 | 1.60 |
| ③ | 800 | 2.0 | 2.0 | a |
| ④ | 900 | 1.0 | 1.0 | b |
| A. | 实验①中,若10min达到平衡,则v(D)=9.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=3.2 | |
| C. | 实验③中,达到平衡时A的转化率为60% | |
| D. | 实验④中,达到平衡时,b<1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com