
| A. | 在燃料改造过程中,“煤改气”发生物理变化,“煤改电”发生化学变化 | |
| B. | 硅胶和Na2SO4:10H2O可做袋装食品的干燥剂 | |
| C. | 亚硝酸盐有害身体健康,应禁止作为食品防腐剂 | |
| D. | “天宫”系列飞船使用的碳纤维材料是一种无机非金属材料 |
分析 A.有新物质生成的变化属于化学变化;
B.Na2SO4:10H2O不能够吸水;
C.亚硝酸有毒,含量在一定范围内可以做防腐剂;
D.碳纤维为碳的单质,属于无机物.
解答 解:A.煤的气化过程中发生反应生成新物质,属于化学变化,故A错误;
B.硅胶和Na2SO4可做袋装食品的干燥剂,Na2SO4:10H2O不具有吸水性,不能做干燥剂,故B错误;
C.亚硝酸盐有害身体健康,应严格控制其在食品中的含量,故C错误;
D.碳纤维为碳的单质,属于无机物,所以碳纤维是一种新型无机非金属材料,故D正确;
故选:D.
点评 本题考查了元素化合物知识,涉及环境污染与治理、材料的分类、食品添加剂的使用等,熟悉相关物质的性质是解题关键,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g•cm-1 | 溶解性 |
| 乙二醇 | C2H4O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
| A. | 分液 | B. | 蒸馏 | C. | 冷却至0℃后过滤 | D. | 加水萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 向CuCl2溶液中加入CuO,调节溶液的pH可除去溶液中混有的Fe3+ | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
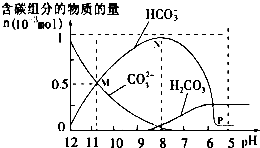 25℃时在10mL0.10mol•L-1Na2CO3溶液中逐滴加入0.10mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示,下列说法正确的是( )
25℃时在10mL0.10mol•L-1Na2CO3溶液中逐滴加入0.10mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示,下列说法正确的是( )| A. | pH=12的溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=7的溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) | |
| C. | pH=8的溶液中:c(Na+)>c(HCO3-)>c(Cl-)>c(OH-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中SO42-的浓度为0.1mol•L-1 | |
| B. | 该溶液中SO42-的物质的量为0.1mol | |
| C. | 与16.0gCuSO4溶于1L水中所得溶液的浓度相等 | |
| D. | 与16.0gCuSO4•5H2O溶于水中,然后稀释至1L所得溶液的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | Fe2(SO4)3和Ba(OH)2溶液混合:2Fe3++3SO42-+3Ba2++6OH-═2Fe(OH)3↓+3BaSO4↓ | |
| C. | 硫酸工厂尾气中的SO2用过量的氨水吸收:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| D. | Cu溶于浓HNO3:Cu+4H++2NO3-═Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
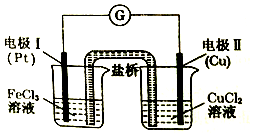
| A. | 盐桥中装有含氯化钾的琼脂,K+移向左池,Cl-移向右池 | |
| B. | 电极I上发生还原反应,电极反应式:Fe3++3e-=Fe | |
| C. | 电极Ⅱ作负极,铜电极逐渐溶解 | |
| D. | 该原电池的总反应为2 Fe3++Cu=Cu2++2Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com