
根据有关知识完成下列问题:
(1)在化学元素中,第一电离能最小的是_____,最大的元素是_________.
(2)铬的原子序数是24,其外层价电子构型是________.
(3)元素的电负性越大,则在分子中此元素________越强.
(4)Be的第一电离能大于B的第一电离能,这是因为________.
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
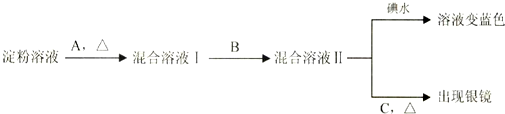
查看答案和解析>>
科目:高中化学 来源: 题型:
请你根据所学知识及有关信息完成下列各题:
(1)H3AsO3中As元素的化合价为_________。
(2)从经济、易得、实用的角度考虑,你认为投入的5.0×104 kg白色固体是_________。
查看答案和解析>>
科目:高中化学 来源:2012届福建省四地六校高二下学期第一次月考化学试卷 题型:填空题
(12分) 图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
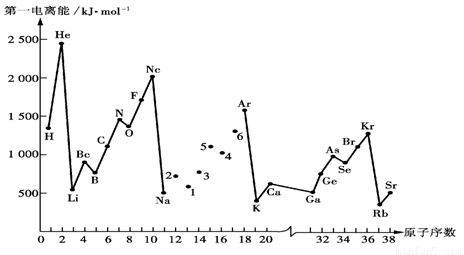
① 将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I1变化规律是;__________________
_________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: _______________________________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com