
等质量的A.甲醇 B.乙醇 C.乙二醇 D.丙三醇
1.完全燃烧后生成的二氧化碳的量由多到少的顺序是_________。
2.燃烧时消耗氧气由少到多的顺序是_______。
3.与足量金属钠反应放出氢气的量由少到多的顺序是_________。 (填序号)
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应条件 | 主要产物 | 生成1mol有机物 △H/kJ?mol-1 |
| Cu-ZnO-Cr2O3-MnO,200~400℃,30~40MPa | 甲醇 | -128 |
| Ni,250~500℃,常压 | 甲烷(和水蒸气) | -206.2 |
| FeO-Co-Ni,150~350℃,0.1~3MPa | 人造石油 | |
| Ru,150~250℃,10~100MPa | 固态烷烃 | |
| ThO-ZnO-Al2O3,400~500℃,10~100MPa | 异丁烷、异戊烷 | |
| Co-Fe,100~200℃,10~20MPa | 含氧有机化合物 | |
| Rh原子簇配合物,高压液相 | 乙二醇 (少量乙酸、乙醇) |

查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期期中考试化学试卷(解析版) 题型:选择题
过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)二茂铁又叫双环戊二烯基铁[化学式:Fe(C5H5)2],结构如图所示,是一种具有芳香族性质的有机金属化合物。外观为橙色,熔点为172℃,沸点249℃,100℃以上能升华;不溶于水,溶于甲醇、乙醇等有机溶剂中。基态Fe2+离子的电子排布式为 。1 mol环戊二烯中含有的σ键的数目是 。
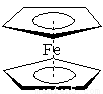
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 。
|
电离能/kJ·mol-1 |
I1 |
I2 |
|
铜 |
746 |
1958 |
|
锌 |
906 |
1733 |
(3)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
试推断紫色晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三上学期期中考试化学试卷 题型:填空题
(11分) 右图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O2  2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
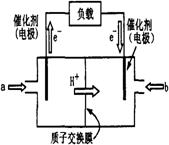
(1)该装置中 (填a或b)为电池的负极,其电极反应为 。
(2)已知任何反应都具有一定的可逆性。该甲醇质子交换膜燃料电池在实际工作中,各反应物、生成物均以气态的形式存在且反应也具有一定可逆性,即其反应原理可表示为2CH3OH(g)+3O2(g) 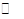 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K=
; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将
(填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将
(填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K=
; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将
(填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将
(填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
(3)又已知在该条件下H2O(l)=H2O(g)ΔH=+akJ·mol-1;CH3OH(l)= CH3OH(g) ΔH=+b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com