
| A. | Na、Mg、Al的金属性依次减弱 | B. | H2S、H2O、HF的稳定性依次减弱 | ||
| C. | Cl-、Br-、I- 还原性依次增强 | D. | Na、K、Rb的原子半径依次增大 |
分析 A.同周期元素从左到右金属性逐渐减弱;
B.元素的非金属性越强,对应的氢化物越稳定;
C.元素的非金属性越强,对应的阴离子还原性越弱;
D.同主族元素从上到下原子半径逐渐增大.
解答 解:A.Na、Mg、Al位于同一周期,同周期元素从左到右金属性逐渐减弱,故A正确;
B.非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.非金属性Cl>Br>I,元素的非金属性越强,对应的阴离子还原性越弱,故C正确;
D.Na、K、Rb位于同一主族,同主族元素从上到下原子半径逐渐增大,故D正确.
故选B.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率 | |
| B. | 单位时间内物质的浓度变化大,则化学反应速率就快 | |
| C. | 对于 2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压 条件下,均不能作为达到化学平衡状态的标志 | |
| D. | 对可逆反应 4NH3(g)+5O2(g)?4NO(g)+6H2O(g),反应达到平衡时,若两种反 应物的转化率相等,则起始投入的n(NH3):n(O2)=4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量Cl2充分反应,转移电子数为0.2×6.02×1023 | |
| B. | 由PbO2+4HCl(浓)═PbCl2+Cl2↑+2H2O可确定氧化性:PbO2>Cl2 | |
| C. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)在常温下能自发进行,则该反应的△H>0 | |
| D. | 常温下,用蒸馏水不断稀释0.1 mol•L-1醋酸,溶液中c(H+)/c(CH3COOH)的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 保护钢铁水闸门可用外接电源阳极保护法 | |
| B. | 反应NH3(g)+HI(g)═NH4I(s)在低温下可自发进行,则△H>0,△S>0 | |
| C. | 常温下,向0.lmol•L-1CH3COONa溶液中滴加盐酸,溶液中水的电离程度增大 | |
| D. | 恒温下进行的反应2NO2(g)?N2O4(g)达平衡时,缩小容器体积再达平衡时,气体 的颜色比第一次平衡时的深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀为Mg(OH)2 | |
| B. | 在加入NaOH过程中生成沉淀最多为13.6g | |
| C. | 生成H2体积为5.6L | |
| D. | 刚加NaOH 溶液就有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
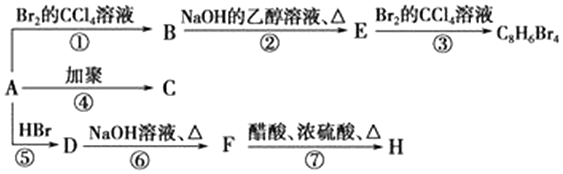
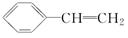 .
.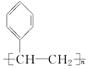 ,D
,D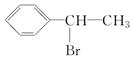 ,E
,E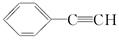 ,H
,H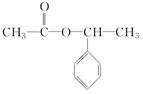 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr.写出⑦反应的化学方程式
+NaBr.写出⑦反应的化学方程式 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$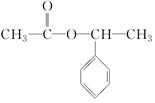 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO3溶液 | B. | MgC12溶液 | C. | BaC12溶液 | D. | FeC13溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制取乙酸乙酯,提高其效率 | 加热,将乙酸乙酯蒸出 |
| B | 比较Mg、Al的金属性 | 分别将打磨过的镁带、铝片放入沸水中 |
| C | 羟基影响与其相连的苯环活性 | 分别将饱和溴水滴入苯和苯酚溶液中 |
| D | 制备Fe2O3固体 | 将H2O(g)通入装有铁粉的试管,加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
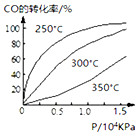 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com