
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源:河北省模拟题 题型:推断题

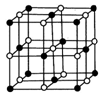
 生成,则
生成,则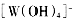 中存在________(填选项字母)
中存在________(填选项字母)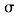 键 e. п键
键 e. п键 查看答案和解析>>
科目:高中化学 来源:辽宁省同步题 题型:推断题
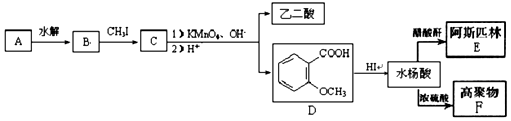
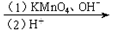 CH3CH2COOH+CH3COOH
CH3CH2COOH+CH3COOH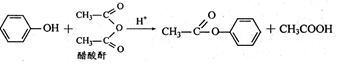
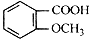 的同分异构体较多。其中属于酯,并且苯环上的一氯代物只有两种的同分异构体的结构简式为______________________苯环上只有两个取代基且处于邻位的同分异构体可以形成比较稳定的环酯,写出一种环酯的结构简式: ____________________。
的同分异构体较多。其中属于酯,并且苯环上的一氯代物只有两种的同分异构体的结构简式为______________________苯环上只有两个取代基且处于邻位的同分异构体可以形成比较稳定的环酯,写出一种环酯的结构简式: ____________________。 查看答案和解析>>
科目:高中化学 来源:河南省模拟题 题型:填空题
 SO3(g) △H=-98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t98%的硫酸只需外界提供(或可向外界输出)____kJ能量。
SO3(g) △H=-98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t98%的硫酸只需外界提供(或可向外界输出)____kJ能量。 
查看答案和解析>>
科目:高中化学 来源:江西省模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com