
| A. | HCl的溶解性强于H2S | B. | 氯的最高价为+7价 | ||
| C. | HCl的稳定性强于H2S | D. | HClO的氧化性强于H2SO4 |
分析 比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断.
解答 解:A、非金属性强弱与氢化物的溶解性无关,则不能根据溶解性来判断非金属性,故A不选;
B、不能根据最高正价判断非金属性,如I也为+7价,但是非金属性:S大于I,故B不选;
C、非金属性越强,氢化物的稳定性越强,氯化氢比硫化氢更稳定,能说明氯的非金属性比硫强,故C选;
D、非金属性越强,最高价氧化物的水化物的酸性越强,HClO不是最高价含氧酸,所以不能说明氯的非金属性比硫强,故D不选;
故选C.
点评 本题考查了非金属性强弱比较,解决该题的关键是明确非金属性强弱比较的判断依据,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和创新思维能力.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 | |
| B. | 第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 | |
| C. | 第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
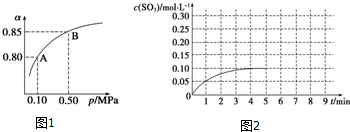
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
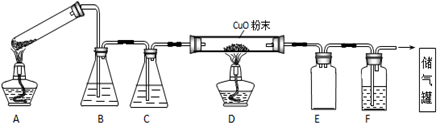
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com