
【题目】下列叙述不正确的是
A. 蔗糖水解生成的两种有机物互为同分异构体
B. 含有5个碳原子的饱和链烃,其一氯代物有3种
C. 乙烷与氯气在光照下发生反应的产物可能有10种
D. 金刚烷的结构为![]() ,它的二氯化物有六种(不考虑立体异构)
,它的二氯化物有六种(不考虑立体异构)
【答案】B
【解析】
A. 蔗糖水解得到葡萄糖和果糖,分子式均为C6H12O5,为同分异构体,A项不符合题意;
B.五个碳原子的饱和链烃为戊烷,戊基有8种,因此戊烷的一氯代物有8种,B项符合题意;
C.乙烷和氯气光照,其产物,包括一氯乙烷(1种)、二氯乙烷(有2种,分别是1,1-二氯乙烷,1,2-二氯乙烷)、三氯乙烷(有2种1,1,1-三氯乙烷,1,1,2-三氯乙烷)、四氯乙烷(2种)、五氯乙烷(1种)、六氯乙烷(1种),氯代烃一共9种,还有HCl,产物可能有10种;C项不符合题意;
D.可以对金刚烷上的氢作如图![]() 所示的标号,二氯代物氯的位置分别为①①、①②、①③、①④、①⑤、②⑥共6种;D项不符合题意;
所示的标号,二氯代物氯的位置分别为①①、①②、①③、①④、①⑤、②⑥共6种;D项不符合题意;
本题答案选B。
甲基 | 乙基 | 丙基 | 丁基 | 戊基 |
1 | 1 | 2 | 4 | 8 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含有离子键的化合物必是离子化合物
B. 含有共价键的化合物就是共价化合物
C. 共价化合物可能含离子键
D. 离子化合物中不可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+I2(g)![]() 2HI(g) ΔH<0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是 ( )
2HI(g) ΔH<0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是 ( )
A. 恒温,压缩体积,平衡不移动,颜色加深
B. 恒压,迅速充入HI,开始时正反应速率减小
C. 恒容,升温逆反应速率增大,正反应速率减小
D. 恒容,充入H2,I2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应H2(g)+I2(g)![]() 2HI(g) H<0,若在恒容绝热容器中发生,下列选项表明反应一定已达平衡状态的是
2HI(g) H<0,若在恒容绝热容器中发生,下列选项表明反应一定已达平衡状态的是
A. 混合气体的密度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开1mol H-H键的同时生成2mol H-I键
D. 容器内气体的浓度c(H2)∶c(I2)∶c(HI) = 1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机研究开创绝不无“钴”的时代,例如:CoCl2·6H2O是一种饲料营养强化剂、草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下图所示:

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
(1)浸出过程中加入Na2SO3的主要离子方程式为____________________。
(2)加入 NaClO3发生可以将溶液中Fe2+氧化,进而调节pH除去,但不能向“浸出液”中加过量 NaClO3的主要原因是:__________________。
(3)若“滤液Ⅰ”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___________mol/L。[已知Ksp(CaF2)=4.0×10-11]
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的选择的标准是___________;其使用的适宜pH范围是___________(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;用化学方程式表示从A点到B点的物质转化___________。C点所示产物的化学式是___________。(Co的相对原子质量是59)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( )
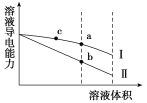
A. 两溶液稀释前的浓度相同
B. a、b、c三点溶液的pH由大到小顺序为a>b>c
C. a点的Kw值比b点的Kw值大
D. a点水电离的n(H+)大于c点水电离的n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol·L1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是______。
(2)本实验需量取浓硫酸的体积为___mL。
(3)在容量瓶使用方法中,下列操作不正确的是_____(填序号)。
A.使用容量瓶前检查它是否漏水
B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
C.将确量取的18.4mol·L1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况使所配制的稀硫酸浓度偏大是_____ (填序号)。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)恒温下,向一个2L的恒容密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示。
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/(mol·L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①前20min的平均速率ν(H2)为__________,该温度下此反应化学平衡平衡常数为_________。
②能提高反应中N2的平衡转化率的是___________。
A.增加N2的浓度 B.增加H2的量 C.移出部分NH3
D.提高反应温度 E.加入合适的催化剂
(2)工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
A、充入氦气增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
(3)已知某化学反应的平衡常数表达式为K=[CO2]·[H2]/[CO]·[H2O],在不同的温度下该反应的平衡常数如下表:
t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
该反应的化学方程式是________________________________;若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应__________达到平衡状态(填是或否)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)基态Ga原子价电子排布图为________。
(2)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___;与NO2+互为等电子体的微粒有_____(写出一种)。
(3)电负性:磷_____硫(填“>”或“<”);第一电离能磷大于硫的原因是________。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:_______________________________。

(5)已知图中正八面体为[PtCl6]2-离子,白球为K+,立方体晶胞边长为a pm,K2PtCl6的相对式量为M,阿伏加德罗常数的值为NA,其密度为________g·cm3(列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com