
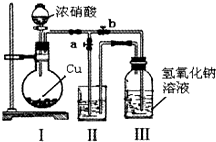
 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:分析 (1)在酸性条件下,NaNO2把碘离子氧化为单质碘,NO2-被还原为NO;
(2)①Ⅰ装置中产生的二氧化氮,与水反应能产生一氧化氮,排到空气中会造成污染;
②装置Ⅲ中反应完全后,要将Ⅰ装置中产生的二氧化氮排到Ⅱ装置中;
(3)NaNO2是强碱弱酸盐,溶液呈碱性,在空气中被氧气氧化成NaNO3是强酸强碱盐,所以会使溶液的pH减小;
(4)①因为高锰酸钾的稀溶液是红色的,所以滴定终点时,溶液会出现红色;
②根据电子得失守恒可知关系式2KMnO4~5NaNO2,由关系式根据消耗的高锰酸钾溶液的物质的量可计算出亚硝酸钠的质量,进而确定隔夜熟肉中NaNO2的含量,并据此判断能否食用.
解答 解:(1)在酸性条件下,NaNO2把碘离子氧化为单质碘,NO2-被还原为NO,其反应的离子方程式为:2NO2-+4CH3COOH+2I-=2NO↑+I2+4CH3COO-+2H2O;
故答案为:2NO2-+4CH3COOH+2I-=2NO↑+I2+4CH3COO-+2H2O;
(2)①Ⅰ装置中产生的二氧化氮,与水反应能产生一氧化氮,排到空气中会造成污染,所以水不能作为装置Ⅱ中的试剂,
故答案为:NO2与水反应生成NO,会污染空气;
②装置Ⅲ中反应完全后,要将Ⅰ装置中产生的二氧化氮排到Ⅱ装置中,所以操作为先打开a,再关闭b,
故答案为:先打开a,再关闭b;
(3)NaNO2是强碱弱酸盐,溶液呈碱性,在空气中被氧气氧化成NaNO3是强酸强碱盐,所以会使溶液的pH减小,而溶液中NaNO2的含量会减小,反应的方程式为2NaNO2+O2=2NaNO3,
故答案为:2NaNO2+O2=2NaNO3;
(4)①因为高锰酸钾的稀溶液是红色的,所以滴定终点时,溶液会出现红色,所以滴定终点的判断依据为:(滴入最后一滴标准液时)锥形瓶内溶液变红,且30秒内不褪色,
故答案为:滴入最后一滴标准液时,锥形瓶内溶液变红,且30秒内不褪色;
②根据题意可知,与隔夜熟肉中提取的NaNO2反应的KMnO4的物质的量为0.00500mol/L×0.02L=1.0×10-4 mol,根据电子得失守恒可知关系式2KMnO4~5NaNO2,由关系式可知亚硝酸钠的质量为$\frac{5}{2}$×1.0×10-4 mol×69g/mol=17.3mg,所以隔夜熟肉中NaNO2的含量为$\frac{17.3mg}{1kg}$=17.3mg/kg;
故答案为:17.3.
点评 本题考查了探究物质含量的测定、氧化还原反应等,题目中等难度,答题时注意把元素化合物知识与实验原理充分结合,注意化学用语的正确书写,侧重于考查学生的分析能力和实验探究能力.


科目:高中化学 来源: 题型:推断题
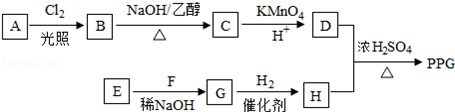
 .
.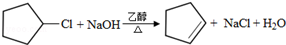 .
.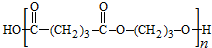 .
.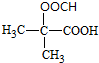 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L溶液中含有0.6 NA个钾离子 | |
| B. | 1 L溶液中含有钾离子和硫酸根离子总数为0.9 NA | |
| C. | 2 L溶液中钾离子浓度为1.2 mol/L | |
| D. | 2 L溶液中含有硫酸根离子0.6 NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),下列说法不正确的是( )
),下列说法不正确的是( )| A. | 它的一氯代物只有一种同分异构体,其二氯代物有两种同分异构体 | |
| B. | 分子中存在极性键、非极性键 | |
| C. | 它不是芳香烃,但与苯乙烯互为同分异构体 | |
| D. | 它含碳质量分数与乙炔、苯等物质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
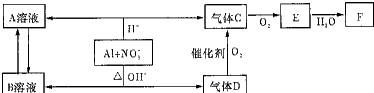
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com