
(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
 )>c(
)>c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )
) )+c(
)+c( )=c(
)=c( )+2c(
)+2c( )+c(
)+c( )
) )+c(
)+c( )=c(
)=c( )+c(
)+c( )
) )、c(
)、c( )、c(
)、c( )分别相等
)分别相等 (每空2分)
(1)> , 1×10—12
(2) 4, 27
(3) Ba2+ + 2OH— + 2H+ + SO42— = BaSO4 ↓+ 2H2O
(4) 1:20
(5) ABC
解析试题分析:(1)t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则Kw = c(H+) ×c(OH-)=10-(a+b)=1×10-12>1×10-14,所以t>25;
(2)未加入硫酸氢钠溶液的Ba(OH)2的稀溶液pH=8,说明Ba(OH)2的稀溶液中c(H+)=10-8 mol/L,则a=8,b=4;33mL的Ba(OH)2的稀溶液加入xmL的pH=4的NaHSO4后pH=7,说明此时溶液显碱性,则c(OH-)×V(Ba(OH)2)- c(H+)×x=1×10-12/1×10-7×(x+33),解得x=27;
(3)反应③是等体积的Ba(OH)2溶液与NaHSO4溶液反应,混合后溶液呈中性,所以离子方程式为Ba2+ + 2OH— + 2H+ + SO42— = BaSO4 ↓+ 2H2O
(4)Ba(OH)2是强碱,1mL的Ba(OH)2溶液中c(Ba2+)="0.5" c(OH-)=1/2×10-4mol/L,稀释1000倍后,c(Ba2+)=5×10-8mol/L,c(OH-)=1×10-7mol/L< c(H+),碱溶液中不可能存在c(OH-) < c(H+),所以此时稀释后的溶液中氢氧根离子浓度按纯水计算,c(OH-)=1×10-6mol/L,则c(Ba2+)﹕c(OH-)= 5×10-8mol/L/1×10-6mol/L=1:20;
(5)NaHSO3溶液呈酸性,说明HSO3-的电离程度大于其水解程度;NaHCO3溶液呈碱性,说明HCO3-的水解程度大于其电离程度。A、若R是S元素,则c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-),正确;B、无论R是哪种元素,都符合电荷守恒规律,正确;C、无论R是哪种元素,都符合物料守恒规律,c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),与c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-)相结合,即得
c(H+)+c(H2RO3)=c(RO32-)+c(OH-),正确;D、两溶液中c(Na+)相等,NaHSO3溶液c(RO32-)较大,但c(HRO3-)无法判断,错误,凳矮矮选ABC。
考点:考查水离子积的比较,混合溶液的计算,离子浓度的比较,守恒规律的应用


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:单选题
下列有关电解质溶液中微粒的关系不正确的是
| A.25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.25℃时,pH=3的氯化铵溶液中: c(OH-)=1.0×10-11mol·L-1 |
| C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 |
| D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能说明醋酸是弱电解质的事实是:
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5
| A.①③④ | B.①② | C.②④ | D.② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)水溶液中存在水的电离平衡。
(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于 。
(2)用“>”、“<”或“=”填空: 碱性溶液中,c(H+) c(OH-),在常温时pH 7。
(3)有下列几种溶液:
| A.NH3·H2O | B.CH3COONa | C.NH4Cl | D.NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。
某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
(1)酸洗时,为使水垢尽可能溶解,不宜选用的是 (填标号)。
| A.醋酸 | B.盐酸 | C.硝酸 | D.稀硫酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: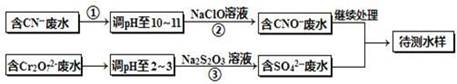
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a =8 | B.x =0.5,a = 10 |
| C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②K (Ni(OH)
(Ni(OH) ): 5.0×10-16 ,K
): 5.0×10-16 ,K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物之一 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀?
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
若100 ℃时纯水电离出的H+浓度为1.0×10-6 mol·L-1,则此时KW= ,c(OH-)= ;25 ℃时的c(H+)=10-2 mol·L-1的硫酸溶液和c(H+)=10-12 mol·L-1的氢氧化钠溶液温度均升高到100 ℃,H+浓度分别是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com