
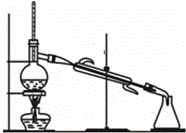
分馏又称为分级蒸馏或精馏.适用于互溶而且沸点相差很小的多组分混合液的分离.控制好温度,便可将各种物质分离.有关分馏操作,下列说法正确的是( )
①液体量不超过烧瓶容积,不少于.
②温度计的水银球应位于蒸馏烧瓶支管口附近.
③为防止暴沸,应在烧瓶中加入沸石或碎瓷片.
④冷凝管中冷却水下进上出,先加热,再通水.
⑤按各组分沸点控制分馏温度,并收集在同一锥形瓶中
⑥停止加热后,应继续通水冷却冷凝管中蒸气.
|
| A. | ①③④ | B. | ②③④ | C. | ③④⑤ | D. | ②③⑥ |
| 蒸馏与分馏.. | |
| 专题: | 化学实验基本操作. |
| 分析: | 蒸馏时为防止蒸馏烧瓶受热不均匀而导致炸裂,蒸馏烧瓶底部必须垫石棉网,为充分冷凝,冷凝管内水的流向是下进上出,为防止暴沸,实验中需在自来水中加几片碎瓷片,温度计的水银球应插入蒸馏烧瓶内支管口附近. |
| 解答: | 解:①液体量不超过烧瓶容积,不少于,故错误; ②温度计的水银球应位于蒸馏烧瓶支管口附近,正确; ③为防止暴沸,应在烧瓶中加入沸石或碎瓷片,正确; ④冷凝管中冷却水下进上出,应先通水,再加热,故错误; ⑤按各组分沸点控制分馏温度,并及时更换锥形瓶,不能收集在同一锥形瓶中,故错误; ⑥停止加热后,应继续通水冷却冷凝管中蒸气,故正确, 故选D. |
| 点评: | 本题考查了蒸馏实验的基本操作及注意事项,明确蒸馏原理是解题关键,注意温度计水银球位置、冷凝水流向,为频考点,易出错. |


科目:高中化学 来源: 题型:
分子式为C6H12O2的有机物A,有香味,不能使紫色石蕊试液变红。A在酸性条件下水解生成有机物B和C。B能和碳酸氢钠溶液反应生成气体;C不能发生消去反应生成烯烃,能催化氧化生成醛或酮。则A可能的结构有( )。
A.1种 B.3种 C.5种 D.多于5种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于仪器使用的说法正确的是
A.在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器
B.熔融纯碱、烧碱时,不能选用石英坩埚,应该选用铁坩埚
C.蒸发结晶实验中,蒸发皿应放在石棉网上加热
D.在测量或监测温度时,温度计水银球碰到容器内壁不影响测量结果
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 向Fe(OH)3胶体溶液中逐滴加入稀硫酸,会逐渐生成红褐色沉淀,当稀硫酸过量,又变成棕黄色溶液,整个过程发生的都是化学变化 |
|
| B. | 某些蛋白质可以分散在溶剂中形成分子胶体,乙醇能使蛋白质变性 |
|
| C. | 不同的气体,若体积不同,则它们所含的分子数也不会相同 |
|
| D. | 有化学键断裂或形成的变化一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2、CaC2等有相似之处.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,则x的值是( )
|
| A. | 5 | B. | 4 | C. | 3 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题:
(1)Cr元素(核电荷数为24)的基态原子电子排布式为 ,这一排布方式符合 (填原理或规则),比较Fe和 Mn的各级电离能后发现,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子 (填“难”或“易”).(每空两分,共6分)
(2)过渡元素有着与主族元素不同的价电子构型,其中外围电子构型为4f75d16s2的元素在周期表中处在 族,该族元素共有 种.
(3)某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应(巨磁电阻效应).用A、B、O表示这类特殊晶体的化学式: .
(4)有一种蓝色晶体可表示为:[KxFey(CN)z],研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,K+位于上述晶胞体心,且K+空缺率为50%(体心中没有K+的占总体心的百分比),其晶体中的阴离子晶胞结构如图2所示,该晶体的化学式可表示为
.
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶
液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是___________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有___________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液 分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
鉴别苯酚溶液、己烷、己烯、乙酸溶液和乙醇液体,可选用的最佳试剂是( )。
A.溴水、新制的Cu(OH)2
B.FeCl3溶液、金属钠、溴水、石蕊试液
C.石蕊试液、溴水
D.KMnO4酸性溶液、石蕊试液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于煤、石油、天然气等资源的说法正确的是 ( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是 一种清洁的化石燃料
一种清洁的化石燃料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com