
分析 (1)水分子间存在氢键,氢键具有方向性和饱和性;
(2)滤液中还含有少量的杂质,温度过低时杂质也会结晶析出.
解答 解:(1)水分子间存在氢键,液态水分子排布不规则,凝固后,排布变规则了,由于氢键具有方向性和饱和性,使得水分子间的空隙变大,所以水变冰后体积增大,密度减小,故冰能浮在水面上;
答:冰晶体中水分子的氢键使水分子间的空隙变大;
(2)在苯甲酸的重结晶实验中,滤液中还含有少量的杂质,放置冷却可以结晶出纯净的苯甲酸晶体,若温度过低,杂质也会结晶析出,使得到的苯甲酸不纯;
答:温度过低时杂质也会结晶析出,得到的苯甲酸不纯.
点评 本题考查了氢键对分子晶体物理性质的影响、重结晶实验操作,题目难度不大,侧重于考查学生的分析能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
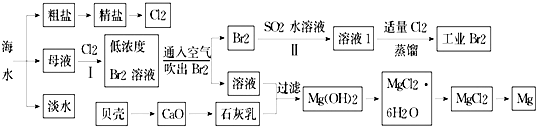
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将干冰放入冰箱 | B. | 让干冰在通风处自然升华 | ||
| C. | 直接将干冰倒入下水道 | D. | 用手取干冰扔入废物箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据燃烧产物中元素的种类可以确定有机化合物中所含元素的种类 | |
| B. | 利用质谱仪记录的质谱图可以精确测定该有机化合物的相对分子质量 | |
| C. | 利用红外光谱仪记录的红外光谱图可以初步推测有机化合物中官能团类别 | |
| D. | 利用核磁共振仪记录的核磁共振氢图可以确定该有机化合物中氢原子的类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的能量总和大于生成物的能量总和 | |
| B. | 上述反应表示生成1体积CO(g)吸收131.4kJ热量 | |
| C. | 在CO(g)+H2(g)═C(s)+H2O(l) 中的△H比-131.4kJ•mol-1小 | |
| D. | C(s)+2H2O(g)═CO2(g)+2H2(g) 中的△H比+131.4kJ•mol-1小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
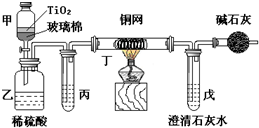 电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.
电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 0.1 mol•L-1CH3COOH溶液中含有0.1NA个CH3COO- | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na2O2,失去个2NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
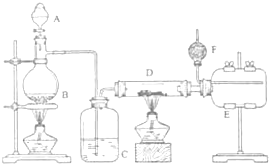 无水氯化铝是有机化工常用催化剂,其外观为白色固体,1780C时升华,极易潮解,遇 水后会发热并产生白雾.实验室用如图装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)→2A1Cl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,1780C时升华,极易潮解,遇 水后会发热并产生白雾.实验室用如图装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)→2A1Cl3+3H2.完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com