
| n |
| V |
| 1.792L |
| 22.4L/mol |
| 10g-4.4g |
| 56g/mol |
| 0.28mol |
| 0.04L |
|


科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 加入浓NaOH溶液,加热 | 湿润的红色石蕊试纸变蓝 | 原溶液中一定含有NH4+ |
| B | 加入稀盐酸,将产生的气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中一定含有CO32- |
| C | 加入少量双氧水,再加几滴KSCN溶液 | 溶液变红 | 原溶液中一定含有Fe2+ |
| D | 加入BaCl2溶液,再加入稀硝酸 | 有白色沉淀生成 | 原溶液中一定含有SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?
某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 |
固体中含有Fe2O3 | |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液? | 产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
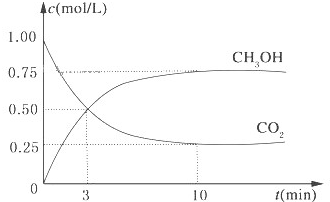 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
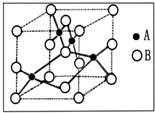 金属铜广泛地应用于电气、机械制造、国防等领域.
金属铜广泛地应用于电气、机械制造、国防等领域.查看答案和解析>>
科目:高中化学 来源: 题型:
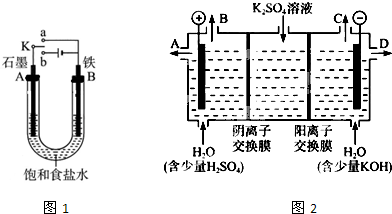
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯能使酸性KMnO4溶液退色,而甲烷不能 |
| B、甲苯能使酸性KMnO4溶液退色,而甲烷不能 |
| C、乙酸能与NaHCO3反应放出气体,而乙醇不能 |
| D、苯硝化反应一般生成硝基苯,而甲苯硝化反应生成三硝基甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com