
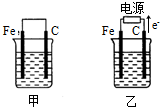
分析 (1)甲为原电池装置,石墨棒作正极,发生还原反应;
(2)乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电.
解答 解:(1)甲为原电池装置,石墨棒作正极,正极反应为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,则电解反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题考查了原电池和电解池原理,根据反应的自发性确定原电池和电解池,再结合离子放电顺序分析解答,同时考查学生分析问题能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol•L-1的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)═c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)═c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某种核素的相对原子质量的近似值 | B. | 某种核素的相对原子质量 | ||
| C. | 某种元素的相对原子质量的近似值 | D. | 某种元素的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸 | |
| B. | 分离苯和硝基苯的混合物,可用蒸馏法 | |
| C. | 除去苯中的杂质苯酚可加入浓溴水后过滤 | |
| D. | 从粗苯甲酸中提纯苯甲酸,可用重结晶法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
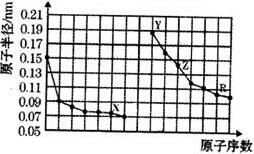
| A. | X、Y两种单质在常温下反应生成的产物为碱性氧化物 | |
| B. | Z2R3可由Y2R和ZCl3的溶液反应制取 | |
| C. | Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡后静置 | 下层呈紫红色 | 氧化性:Fe3+>I2 |
| B | 向稀硫酸中加入少量铁粉 | 溶液变为黄色 | 稀硫酸将Fe氧化成Fe3+ |
| C | 向盛Na2SiO3 溶液的试管中滴加1滴酚酞溶液,然后逐滴加入稀盐酸至红色接近消失时停止,静置 | 试管里出现凝胶 | 非金属性:Cl>Si |
| D | 葡萄糖溶液与新制的氢氧化铜混合加热 | 有砖红色沉淀生成 | 葡萄糖分子中有羟基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
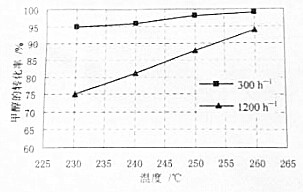 以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
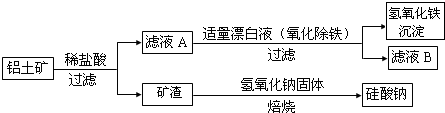
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{r(Na)}{r(N{a}^{+})}$ | B. | $\frac{r({F}^{-})}{r({O}^{2-})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(Ca)}{r(Mg)}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com