
| A. | 该合金中铝的物质的量为 0.2mol | B. | 该合金中镁的物质的量为 2.4g | ||
| C. | 盐酸的物质的量浓度为 4mol/L | D. | 该反应中转移的电子数为0.4NA |
分析 n(H2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,设混合物中Al、Mg的物质的量分别为x、y,则
$\left\{\begin{array}{l}{3x+2y=0.4×2×(1-0)}\\{27x+24y=7.8}\end{array}\right.$
解得x=0.2mol,y=0.1mol,以此来解答.
解答 解:n(H2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,设混合物中Al、Mg的物质的量分别为x、y,
由电子守恒及质量关系可知
$\left\{\begin{array}{l}{3x+2y=0.4×2×(1-0)}\\{27x+24y=7.8}\end{array}\right.$
解得x=0.2mol,y=0.1mol,
A.该合金中铝的物质的量为 0.2mol,故A正确;
B.该合金中镁的物质的量为0.1mol×24g/mol=2.4g,故B正确;
C.由H原子守恒可知,盐酸的物质的量浓度为$\frac{0.4mol×2}{0.2L}$=4mol/L,故C正确;
D.由H元素的化合价变化可知,该反应中转移的电子数为0.8NA,故D错误;
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Si有导电性 | Si可用于制备光导纤维 |
| B | Fe的金属活动性大于Cu | FeCl3溶液可用于回收废旧电路板中的铜 |
| C | Na2O2与水反应能生成碱 | Na2O2属于碱性氧化物 |
| D | 次氯酸光照易分解 | 新制氯水保存在棕色试剂瓶中,放于冷暗处 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 我国规定:室内甲醛含量不得超过0.08mg•m-3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务.(部分装置如图),其反应原理及步骤如下:
我国规定:室内甲醛含量不得超过0.08mg•m-3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务.(部分装置如图),其反应原理及步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag得到电子 | B. | X为AgS | ||
| C. | O2被还原 | D. | 每生成1 mo1X转移电子数4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
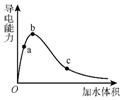 一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com