
| A. | B. | C. | D. |
| 《神农本草经》记载,麻黄能“止咳逆上气” | 胃舒平药片 (复方氢氧化铝)  |  |  秦朝彩俑 |
| 古代中国人已用麻黄治疗咳嗽 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 古代中国人掌握化学制颜料方法 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.麻黄能“止咳逆上气”,则麻黄具有治疗咳嗽的作用;
B.醋中含有乙酸,能和氢氧化铝反应;
C.该标志为放射性物质标志;
D.秦朝能够制造彩俑,说明已经掌握化学制颜料方法.
解答 解:A.麻黄能“止咳逆上气”,则麻黄具有治疗咳嗽的作用,可以制作咳嗽药,故A正确;
B.醋中含有乙酸,能和氢氧化铝反应,从而降低疗效,故B错误;
C.该标志为放射性物质标志,对环境及人有危害,所以 看到有该标志的丢弃物,应远离并报警,故C正确;
D.秦朝能够制造彩俑,说明已经掌握化学制颜料方法,故D正确;
故选:B.
点评 本题考查信息及标志,侧重考查学生对基本生活常识及基本标志的了解,知道化学在生产生活中的应用,会运用化学知识解决生产生活问题,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 金刚石与互为石墨同分异构体 | |
| B. | 石墨比金刚石稳定 | |
| C. | 浓硫酸与稀氢氧化钠溶液反应的中和热为-57.3kJ | |
| D. | 稀硫酸和稀Ba(OH)2溶液反应生成1molH2O时的热效应是-57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
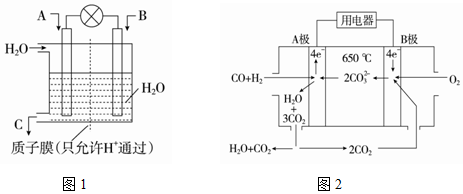
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色 | 水中溶解性 |
| Fe2S3 | 黑色 | 难溶于水 |
| FeS | 黑褐色 | 难溶于水 |
| 实验步骤 | 操作 | 现象 | 备注 |
| 1 | 向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液 | 产生黑色沉淀,立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
| 2 | 继续滴加3滴0.1mol/L 硫化钠溶液 | 同上 | |
| 3 | 继续滴加0.1mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
| 实验步骤 | 操作 | 现象 |
| 4 | 向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
| 5 | 继续滴加3滴0.1mol/L 氯化铁溶液 | 同上 |
| 6 | 继续滴加0.1mol/L 氯化铁溶液至过量 | 同上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| B. | 近期出现在北方的雾霾是一种分散系,带活性炭口罩的原理是吸附作用 | |
| C. | 我国部分城市在推广使用的“甲醇汽油”有降低排放废气的优点,无任何负面作用 | |
| D. | 亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
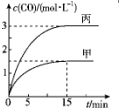 一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、 1mol H2O(g) | 1mol CO、 1mol H2 | 4mol C、 2mol H2O(g) |
| A. | 丙容器的容积V<0.5L | |
| B. | 甲容器中,反应在前15 min内的平均反应速率v(H2)=0.15 mol•L-1•min-1 | |
| C. | 当温度为T1℃时,反应的平衡常数K=2.25 | |
| D. | 乙容器中,若平衡时n(H2O)=0.3 mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2在反应中作氧化剂 | B. | 该反应转移了4e- | ||
| C. | Hg是被还原得到的产物 | D. | HgS既是还原剂又是氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com