
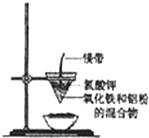
 ŃŠ¾æŠŌѧĻ°Š”×éµÄĶ¬Ń§ĆĒÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠĀĮČČ·“Ó¦µÄŹµŃ飬Ēė»Ų“š£ŗ
ŃŠ¾æŠŌѧĻ°Š”×éµÄĶ¬Ń§ĆĒÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠĀĮČČ·“Ó¦µÄŹµŃ飬Ēė»Ų“š£ŗ| ĪļÖŹ | Al | Al2O3 | Fe | Fe2O3 |
| ČŪµć/”ę | 660 | 2054 | 1535 | 1462 |
| ·Šµć/”ę | 2467 | 2980 | 2750 | - |
·ÖĪö £Ø1£©½šŹōĀĮÓėŃõ»ÆĢśøßĪĀĻĀ·“Ӧɜ³ÉĢśŗĶŃõ»ÆĀĮµÄ·½³ĢŹ½£»
£Ø2£©Ć¾ÓėŃõĘų·“Ӧɜ³ÉŃõ»ÆĆ¾£¬·ÅČČ“óĮæČČ£¬ĀĮČČ·“Ó¦ÖŠĆ¾“ųĘšµ½ĮĖŅżČ¼¼ĮµÄ×÷ÓĆ£»ĀČĖį¼ŲŹÜČČ·Ö½āÉś³ÉŃõĘųĘšÖśČ¼µÄ×÷ÓĆ£»
£Ø3£©µ±½šŹōĢś³ŹŅŗĢ¬Ź±£¬ÓÉÓŚ½šŹōĀĮµÄČŪµć±ČĢśµĶ£¬ĖłŅŌ½šŹōĀĮŅ²ŹĒŅŗĢ¬£»¼ČÄÜŗĶ½šŹōĢś·“Ó¦ÓÖÄÜŗĶ½šŹōĀĮ·“Ó¦µÄĪļÖŹŹĒĻ”ĮņĖį”¢Ļ”ĻõĖį£®
½ā“š ½ā£ŗ£Ø1£©øßĪĀĻĀ£¬½šŹōĀĮÄܹ»ÓėŃõ»ÆĢś·“Ó¦ÖĆ»»³öĢś£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗFe2O3+2Al$\frac{\underline{\;øßĪĀ\;}}{\;}$2Fe+Al2O3£¬¹Ź“š°øĪŖ£ŗ2Al+Fe2O3 $\frac{\underline{\;øßĪĀ\;}}{\;}$2Fe+Al2O3£»
£Ø2£©Ć¾ŌŚæÕĘųÖŠ¾ēĮŅČ¼ÉÕ£¬·Å³ö“óĮæČČ£¬Ć¾ĢõŌŚĀĮČČ·“Ó¦ÖŠĢį¹©ČČĮæ£¬Ęšµ½ŅżČ¼¼ĮµÄ×÷ÓĆ£¬ĀČĖį¼ŲŹÜČČ·Ö½āÉś³ÉŃõĘųĘšÖśČ¼µÄ×÷ÓĆ£»
¹Ź“š°øĪŖ£ŗČ¼ÉÕŹ±Ģį¹©ČČĮ棬Ņż·¢·“Ó¦£»ŹÜČČ·Ö½āĢį¹©ŃõĘų£¬°ļÖśĆ¾ĢõČ¼ÉÕ£»
£Ø3£©øł¾Ż±ķÖŠµÄŹż¾ŻæÉŅŌ擳ö£¬½šŹōĀĮµÄČŪµćµć±ČĢśµĶ£¬µ±½šŹōĢśŹĒŅŗĢ¬Ź±£¬½šŹōĀĮŅ²ŹĒŅŗĢ¬£¬ĖłŅŌĀĮČČ·“Ó¦µĆµ½µÄŹĒ½šŹōĢśŗĶ½šŹōĀĮµÄ»ģŗĻĪļ£»
ĮņĖįŃĒĢś”¢ĒāŃõ»ÆÄĘČÜŅŗ²»ÓėĢś·“Ó¦£¬ĖłŅŌ¼ČÄÜŗĶ½šŹōĢś·“Ó¦ÓÖÄÜŗĶ½šŹōĀĮ·“Ó¦µÄĪļÖŹĪŖĻ”ĮņĖį£¬Ļ”ĻõĖį£¬¹ŹBCÕżČ·£¬
¹Ź“š°øĪŖ£ŗAl”¢Fe£» BC£®
µćĘĄ ±¾Ģāæ¼²éĀĮČČ·“Ó¦£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāÕĘĪÕĀĮČČ·“Ó¦ŌĄķ£¬Ć÷Č·ŗĻ½šĢŲµć¼°½šŹōĢś”¢Ć¾µÄ»ÆѧŠŌÖŹ£¬ŹŌĢā²ąÖŲæ¼²éѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°»ÆѧŹµŃéÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 °±¼ČŹĒŹµŃéŹŅÖŠ³£ÓĆŹŌ¼Į£¬Ņ²ŹĒ¹¤ŅµÉĻÖŲŅŖŌĮĻ£®
°±¼ČŹĒŹµŃéŹŅÖŠ³£ÓĆŹŌ¼Į£¬Ņ²ŹĒ¹¤ŅµÉĻÖŲŅŖŌĮĻ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ü | B£® | ¢Ł¢Ś | C£® | ¢Ū¢Ż | D£® | ¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·ŁÉÕ½ÕøŃ£¬»¹·ŹÓŚĢļ | B£® | ¾»»Æ·ĻĖ®£¬Ń»·ĄūÓĆ | ||
| C£® | µĶĢ¼³öŠŠ£¬Ö²Ź÷ŌģĮÖ | D£® | æŖ·¢·ēÄÜ£¬ĄūÓƵŲČČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | K2SO4”¢HNO3”¢BaCl2 | B£® | NaOH”¢NH4Cl”¢Mg£ØNO3£©2 | ||
| C£® | NH4HCO3”¢KCl”¢NaCl | D£® | KMnO4”¢NaCl”¢H2SO4 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com