
科目:高中化学 来源: 题型:
| 难溶 电解质 |
AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||

查看答案和解析>>
科目:高中化学 来源: 题型:
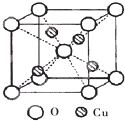 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价.查看答案和解析>>
科目:高中化学 来源: 题型:
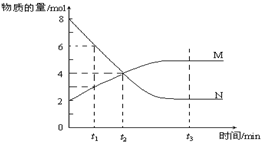
| A、该反应的化学方程式为:N?2M |
| B、t1时,正反应速率大于逆反应速率 |
| C、t2时,正逆反应速率相等,达到平衡 |
| D、t3时,M、N的浓度不再发生变化,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液漏斗分离环己烷和苯的混合液体 |
| B、溴乙烷10%的烧碱溶液中,加热片刻后,冷却,先加过量的硝酸,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子 |
| C、做银镜反应实验时应将醛溶液和新制备的银氨溶液混合后充分加热至沸腾 |
| D、实验室制溴苯时选用的试剂是浓溴水、苯和铁屑 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com