
【题目】A、B、C、W 均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去, 反应可以在水溶液中进行):
![]()
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C 为红棕色气体,与水反应生成一元强酸D,D 具有强氧化性。
(1)在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为____________。
(2)工业上常用Na2CO3溶液吸收 C,生成等物质的量的两种钠盐,该反应的离子方程式为___________。
Ⅱ.A、B、C 三种物质的溶液均显碱性,焰色反应均为黄色;C 常作面包和糕点的发泡剂,受热分解可生成B。
(3)实验室需配制 0.1 mol·L-1A溶液 450mL。根据计算用托盘天平称取 A 的质量为______g,在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_________0.1mol·L-1 (填“大于”“等于”或“小于”)。
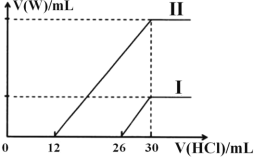
(4)若将标准状况下2.24L的W通入150mL1mol·L-1的A溶液中,充分反应。总反应的离子方程式为_______。向两份30mL同浓度的A溶液中通入不同体积的 W 气体,得到溶液 M、N。向 M、N 溶液中逐滴加入浓度为0.2 mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积 V(HCl)与产生 W 气体的体积 V(W)的关系。则A溶液的物质的量浓度为____mol·L-1,M、N 两溶液中相同溶质的物质的量之比为______。
【答案】![]() 2NO2+CO32—=NO3—+NO2—+CO22.0小于3OH-+2CO2=CO32-+ HCO3-+H2O0.21:3
2NO2+CO32—=NO3—+NO2—+CO22.0小于3OH-+2CO2=CO32-+ HCO3-+H2O0.21:3
【解析】
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性,则A是NH3;C 为红棕色气体,与水反应生成一元强酸D,D 具有强氧化性,则D是硝酸、C是NO2、B是NO、W是O2。Ⅱ.A、B、C 三种物质的溶液均显碱性,焰色反应均为黄色;C 常作面包和糕点的发泡剂,受热分解可生成B,则C是NaHCO3、B是Na2CO3、A是NaOH、W是CO2;
(1)根据以上分析,A是NH3、C是NO2,在催化剂作用下,NH3与NO2反应可生成两种无污染物质是N2和H2O,该反应化学方程式为![]() ; (2)工业上常用Na2CO3溶液吸收NO2,NO2既是氧化剂又是还原剂,氧化产物是NaNO3,生成等物质的量的两种钠盐,根据得失电子守恒,还原产物是NaNO2,该反应的离子方程式为2NO2+CO32—=NO3-+NO2-+CO2;(3)根据以上分析,A是NaOH,实验室需配制 0.1 mol·L-1 NaOH溶液 450mL,选用500mL的容量瓶,
; (2)工业上常用Na2CO3溶液吸收NO2,NO2既是氧化剂又是还原剂,氧化产物是NaNO3,生成等物质的量的两种钠盐,根据得失电子守恒,还原产物是NaNO2,该反应的离子方程式为2NO2+CO32—=NO3-+NO2-+CO2;(3)根据以上分析,A是NaOH,实验室需配制 0.1 mol·L-1 NaOH溶液 450mL,选用500mL的容量瓶,![]() ,所以用托盘天平称取 A 的质量为2.0g,在实验中其他操作均正确,若定容时仰视刻度线,溶液体积偏大,则所得溶液浓度小于0.1mol·L-1。(4)若将标准状况下2.24L的二氧化碳通入150mL1mol·L-1的氢氧化钠溶液中,充分反应,根据元素守恒,生成等物质的量的碳酸钠和碳酸氢钠,所以总反应的离子方程式为3OH-+2CO2=CO32-+ HCO3-+H2O。根据图像,加入30ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒, n(NaOH)=n(NaCl)=n(HCl)=0.03L×0.2mol/L=0.006mol,则氢氧化钠溶液物质的量浓度C=0.006mol
,所以用托盘天平称取 A 的质量为2.0g,在实验中其他操作均正确,若定容时仰视刻度线,溶液体积偏大,则所得溶液浓度小于0.1mol·L-1。(4)若将标准状况下2.24L的二氧化碳通入150mL1mol·L-1的氢氧化钠溶液中,充分反应,根据元素守恒,生成等物质的量的碳酸钠和碳酸氢钠,所以总反应的离子方程式为3OH-+2CO2=CO32-+ HCO3-+H2O。根据图像,加入30ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒, n(NaOH)=n(NaCl)=n(HCl)=0.03L×0.2mol/L=0.006mol,则氢氧化钠溶液物质的量浓度C=0.006mol![]() 0.030L=0.2mol/L;(2)碳酸钠溶液中加入逐滴滴入盐酸,依次发生反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,依据情况Ⅰ可知,26-30段为碳酸氢钠与盐酸反应,则溶液中Na2CO3+HCl=NaHCO3+NaCl消耗的盐酸体积为30-26=4ml,说明溶质为碳酸钠与氢氧化钠混合物,依据方程式:Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.004L×0.2molL-1=0.0008mol;依据情况Ⅱ可知,12-30段为碳酸氢钠与盐酸反应,若溶质为碳酸钠则溶液中碳酸钠消耗的盐酸体积为30-12=18mL,而Ⅱ中0-12mL<18mL,说明B中溶质为碳酸钠和碳酸氢钠,前10m盐酸为碳酸钠与盐酸反应生成碳酸氢钠,依据Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.012L×0.2molL-1=0.0024mol;所以M、N两溶液中相同组分溶质的物质的量之比为0.0008mol:0.0024mol=1:3。
0.030L=0.2mol/L;(2)碳酸钠溶液中加入逐滴滴入盐酸,依次发生反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,依据情况Ⅰ可知,26-30段为碳酸氢钠与盐酸反应,则溶液中Na2CO3+HCl=NaHCO3+NaCl消耗的盐酸体积为30-26=4ml,说明溶质为碳酸钠与氢氧化钠混合物,依据方程式:Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.004L×0.2molL-1=0.0008mol;依据情况Ⅱ可知,12-30段为碳酸氢钠与盐酸反应,若溶质为碳酸钠则溶液中碳酸钠消耗的盐酸体积为30-12=18mL,而Ⅱ中0-12mL<18mL,说明B中溶质为碳酸钠和碳酸氢钠,前10m盐酸为碳酸钠与盐酸反应生成碳酸氢钠,依据Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.012L×0.2molL-1=0.0024mol;所以M、N两溶液中相同组分溶质的物质的量之比为0.0008mol:0.0024mol=1:3。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】如下图表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
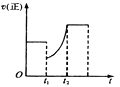
A. t1时增加了SO2和O2的浓度,平衡向正反应方向移动
B. t1时降低了温度,平衡向正反应方向移动
C. t1时减小了压强,平衡向逆反应方向移动
D. t1时减小了SO2的浓度,又增加了SO3的浓度,导致平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图

下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
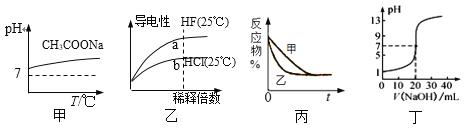
A. 图甲表示升高温度醋酸钠的水解程度增大,溶液碱性增强
B. 图乙表示氢氟酸为弱酸,且a点Kw的数值比b点Kw的数值大
C. 图丙表示压强对可逆反应2A(g) +2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 图丁表示0.100 0 mol·L1 NaOH溶液滴定20.00 mL 0.100 0 mol·L1醋酸溶液的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铁、锌、镁、铝四种金属中的两种组成的10g混合物与足量的盐酸反应,反应后生成的氢气在标准状况下体积为11.2L.则混合物中一定含有的金属是( )
A.锌B.铁C.镁D.铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是地球大气中一种微量气体,人类正在保护和利用臭氧。
(1)氮氧化物会破坏臭氧层,已知:
①NO(g) + O3(g)![]() NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
②2NO(g) +O2 (g)![]() 2NO2 (g) ΔH 2 = 116.2 kJ·mol1
2NO2 (g) ΔH 2 = 116.2 kJ·mol1
则反应:2O3(g)![]() 3O2 (g) ΔH=______。
3O2 (g) ΔH=______。
(2)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,加热充分反应后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为______。
(3)大气中的部分碘源于O3对海水中I—的氧化。将O3持续通入NaI溶液中进行模拟研究,探究Fe2+对氧化I—反应的影响,反应体系如图1,测定两组实验中I3—浓度实验的数据如图2所示:
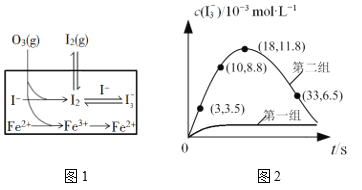
①反应后的溶液中存在化学平衡:I2(aq)+I(aq) ![]() I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
②结合实验数据可知,Fe2+对I的转化率的影响是_____(填“增大”“无影响”或“减小”)。
③第二组实验18 s后,I3—浓度下降。导致I3—浓度下降的原因是_____。
(4)臭氧是一种杀菌消毒剂,还是理想的烟气脱硝剂。
①一种脱硝反应中,各物质的物质的量随时间的变化如图3所示,X为___(填化学式)。
②一种臭氧发生装置原理如图4所示。阳极(惰性电极)的电极反应式为____。
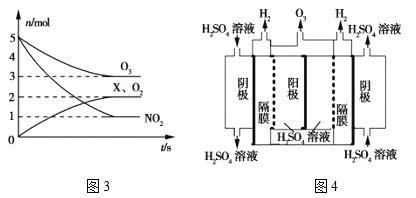
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的硝酸亚铁溶液存在如下平衡:Fe2++2H2OFe(OH)2+2H+,若在此溶液中加入盐酸,则溶液的颜色( )
A.变深B.变浅C.变黄D.不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com