
分析 (1)根据n=$\frac{m}{M}$可知,相同质量的气体物质的量之比与摩尔质量成反比,再根据V=nVm可知,相同条件下气体体积之比等于物质的量之比;根据相同条件下,密度之比等于摩尔质量之比;
(2)同温同压下的气体体积相同,根据V=nVm可知,则二者物质的量相同,根据m=nM可知,质量之比等于摩尔质量之比;
(3)由平均摩尔质量=$\frac{m}{M}$来计算,由质量和物质的量的关系列方程解出甲烷的物质的量,再计算混合气体中甲烷的体积和一氧化碳的质量.
解答 解:(1)X、Y两种气体分子的相对分子质量分别为A、B.
同温同压下,根据n=$\frac{m}{M}$可知,同质量的X、Y气体物质的量之比=Bg/mol:Ag/mol=B:A,再根据V=nVm可知,相同条件下气体体积之比等于物质的量之比=B:A,分子个数比为B:A,根据相同条件下,密度之比等于摩尔质量之比=Ag/mol:Bgmol=A:B,
故答案为:B:A;B:A;A:B;
(2)同温同压下,X、Y气体体积相同,根据V=nVm可知,则X、Y气体物质的量之比为1:1,根据m=nM可知,质量之比等于摩尔质量之比=Ag/mol:Bgmol=A:B,
故答案为:A:B;1:1;
(3)标准状况下,8.96L气体的物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,设甲烷的物质的量为x,CO的物质的量为y,
则$\left\{\begin{array}{l}{x+y=0.4mol}\\{16x+28y=7.6g}\end{array}\right.$,解得x=0.3mol,y=0.1mol,
混合气体平均摩尔质量为$\frac{7.6g}{0.4mol}$=19g/mol,
混合气体中甲烷的体积为0.3mol×22.4mol/L=6.72L,
一氧化碳的质量为:0.1mol×28g/mol=2.8g,
故答案为:19g/mol;6.72L;2.8g.
点评 本题考查了以物质的量为中心的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,注意把握相关计算公式的运用以及物质的构成特点.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 同系物符合同一通式 | B. | 同分异构体具有相同的分子式 | ||
| C. | 同分异构体的化学性质基本相同 | D. | 同系物的化学性质基本相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 橙花醛能够发生氧化反应,不能发生还原反应 | |
| B. | 橙花醛可以使溴水褪色 | |
| C. | 橙花醛是丙烯醛是同系物 | |
| D. | 橙花醛与分子式为C10H20O的酮互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
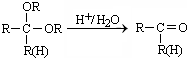
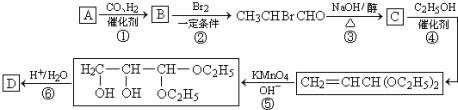
 CH2=CHCHO+NaBr+H2O.
CH2=CHCHO+NaBr+H2O.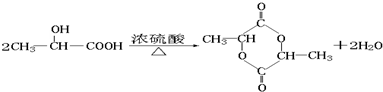 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 比较 | 碳循环 | 硫循环 |
| A | 异 | 碳元素会进入大气 | 硫元素不会进入大气 |
| B | 碳元素可以有机物形式参与循环 | 硫元素都以无机物形式参与循环 | |
| C | 同 | 人类活动对碳循环和硫循环都造成了巨大影响 | |
| D | 碳循环和硫循环对环境的影响是都能形成酸雨 | ||
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
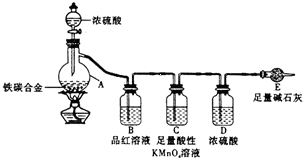 某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,水解平衡常数增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com