
A.a一定大于b
B.a一定小于b
C.若元素A、B在同一周期,则a一定大于b
D.若元素A、B不在同一周期,则a一定大于b
科目:高中化学 来源: 题型:阅读理解
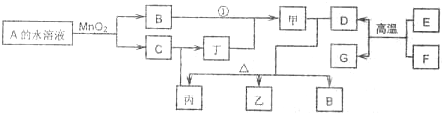
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题:
A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题: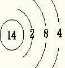

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素代号 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读下表中部分短周期主族元素的相关信息:
| 元素代号 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
请回答:
(1)元素T与X按原子个数比1:1形成的化合物B属于有 晶体。已知在通常条件下,39g B与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式 。
(2)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),此过程中实验现象 。
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移 mol电子
(4)在一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省福州三中高三(上)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com