
| ||
| 4min |
| 1 |
| 2 |
| 1 |
| 2 |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、升高温度,平衡逆向移动 |
| B、当容器中气体压强不变时,反应达到平衡 |
| C、平衡后加入X,上述反应的△H增大 |
| D、平衡后加入少量W,逆反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1mol氦气和22.4L氮气所含的原子个数均为2NA |
| B、1molH2O和1molOH-中所含电子数均为10NA |
| C、1molNa2O2中含有的阴离子数为2NA |
| D、铝与足量盐酸反应,生成2.24LH2时,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
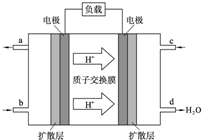 以甲烷(CH4)、合成气(CO和H2)、CO2、甲醇(CH3OH)、甲醛(HCHO)等为初始反应物可以反应合成一系列重要的化工原料和燃料.其中作为初始反应物的甲醇是一种可再生能源,具有广泛的开发和应用前景.
以甲烷(CH4)、合成气(CO和H2)、CO2、甲醇(CH3OH)、甲醛(HCHO)等为初始反应物可以反应合成一系列重要的化工原料和燃料.其中作为初始反应物的甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温 度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CuO、CuCl2 |
| 400℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| B、向某溶液中先滴加CaCl2溶液,产生白色沉淀,再滴加稀盐酸沉淀溶解并产生无色气体,该气体能使澄清石灰水变浑浊,则该溶液中一定有CO32- |
| C、液溴易挥发,存放液溴应加水封,并保存在棕色试剂瓶中 |
| D、向某溶液中先滴加BaCl2溶液,产生白色沉淀,再滴加稀盐酸白色沉淀不溶解,该溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧不一定有氧气参加 |
| B、只要有盐和水生成的反应就一定是中和反应 |
| C、一种单质和一种化合物发生的反应不一定是置换反应 |
| D、饱和溶液析出晶体后,剩余溶液中溶质的质量分数可能不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com