
| A. | 电池的正极发生的反应:O2+4e-═2O2- | |
| B. | 负极发生的反应:CH4+4O2--8e-═CO2+2H2O | |
| C. | 固体电解质里的O2-的移动方向:由正极流向负极 | |
| D. | 向外电路释放电子的电极:正极(电子由正极流向负极) |
分析 该燃料电池中,正极上氧气得电子生成氧离子;负极上甲烷失电子和氧离子反应生成二氧化碳和水;原电池放电时,电解质中阴离子向负极移动,失电子的极是负极,据此回答判断.
解答 解:A、该燃料电池中,正极上氧气得电子生成氧离子,电极反应式为O2+4e-=2O2-,故A正确;
B、负极上甲烷失电子和氧离子反应生成二氧化碳和水,电极反应式为CH4-8e-+4O2-=CO2+2H2O,故B正确;
C、放电时,电解质中阴离子向负极移动、阳离子向正极移动,所以氧离子向负极移动,故C正确;
D、向外电路释放电子的电极:是负极,电子从负极流向正极,故D错误.
故选D.
点评 本题考查化学电源新型电池,明确原电池原理是解本题关键,侧重考查学生书写电极反应式,书写时要结合电解质特点书写,燃料和氧化剂相同,如果电解质不同其电极反应式不同.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 (1)意大利科学家FulvioCacace等获得了极具理论研究意义的N4分子.N4分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,计算1molN4气体转变为N2气体的△H=-882 kJ•mol-1
(1)意大利科学家FulvioCacace等获得了极具理论研究意义的N4分子.N4分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,计算1molN4气体转变为N2气体的△H=-882 kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.6 mol/(L•s) | B. | v (B)=0.4mol/(L•s) | C. | v (C)=0.9 mol/(L•s) | D. | v (D)=1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
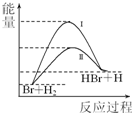 相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )
相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 反应热:过程I>过程II | |
| C. | 过程Ⅱ的平衡常数>过程I的平衡常数 | |
| D. | 形成1 mol 化学键释放的能量:H-Br<H-H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 废塑料制品属于可焚烧处理的垃圾 | |
| B. | 误食重金属离子时,立即喝大量牛奶缓解毒性 | |
| C. | 铁钉在氯化钠溶液中锈蚀的速率比在蒸馏水中的快 | |
| D. | 家用燃料燃烧、烹调和吸烟是室内空气污染物的重要来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O?H++Cl-+HClO | B. | NH4++2H2O?NH3•H2O+H3O+ | ||
| C. | HS-+H+═H2S | D. | HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | pH相同的盐酸和醋酸溶液,加水稀释100倍后两溶液pH仍相同 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 25℃,将pH=5的盐酸稀释1000倍后,溶液的pH=8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com