
| A. | 通入了1 molCl2的新制氯水中,HClO、Cl-、C1O-粒子数之和为2NA | |
| B. | 标准状况下,22.4L NH3和HCl的混合气体中含有的分子总数为NA | |
| C. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02NA | |
| D. | 高温下,0.3mol Fe与足量的水蒸气完全反应失去的电子数为0.8NA |
分析 A、氯气和水的反应为可逆反应;
B、氨气和HCl混合后会反应生成氯化铵;
C、溶液体积不明确;
D、铁和水蒸汽反应后变为+$\frac{8}{3}$.
解答 解:A、氯气和水的反应为可逆反应,故氯水中有未反应的氯气分子,即溶液中的HClO、Cl-、C1O-粒子数之和小于2NA,故A错误;
B、氨气和HCl混合后会反应生成氯化铵固体,故标准状况下,22.4L NH3和HCl混合后无分子,生成了氯化铵固体这种离子晶体,故B错误;
C、由于pH=1的硫酸溶液的体积不明确,故溶液中的氢离子的个数无法计算,故C错误;
D、铁和水蒸汽反应后变为+$\frac{8}{3}$,故0.3mol铁反应后失去0.8mol电子即0.8NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 阴离子的还原性C2-<D- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCOOH、CH3COOCH=CH2均可作为合成聚合物的单体 | |
| B. | C6Hn分子中的六个碳原子在同一直线上,则n可能等于2 | |
| C. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 | |
| D. | 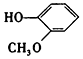 与 与 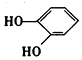 都是酚且互为同系物 都是酚且互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O | B. | H2SO4+CuO═CuSO4+H2O | ||
| C. | 2 H2S+SO2═3S↓+2H2O | D. | CO2+Ca(OH)2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、聚乙烯和苯均能发生加成反应 | |
| B. | lmol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| C. | 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体 | |
| D. | 戊烷的一氯代物和丙烷的二氯代物的同分异构体数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
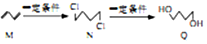 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M至N的反应类型是取代反应 | |
| B. | N的同分异构体有6种 | |
| C. | 可用酸性KMnO4溶液区分N与Q | |
| D. | 0.3molQ与足量金属钠反应生成0.15NA个H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
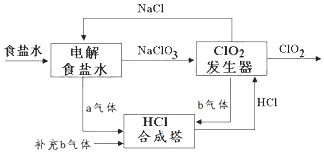 ClO2 是一种高效安全的杀菌消毒剂.用氯化钠电解法生成ClO2的工艺原理示意图如图,发生器内电解生成ClO2.下列说法正确的是( )
ClO2 是一种高效安全的杀菌消毒剂.用氯化钠电解法生成ClO2的工艺原理示意图如图,发生器内电解生成ClO2.下列说法正确的是( )| A. | a气体是氯气,b气体是氢气 | |
| B. | 氯化钠电解槽内每生成2 mol a气体,转移2mol e- | |
| C. | ClO2发生器中阴极的电极反应式为:2ClO3-+12H++10e-═Cl2↑+6H2O | |
| D. | 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
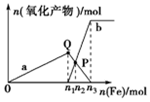 含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )
含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )| A. | 曲线a表示Fe2+,曲线b表示Fe3+ | |
| B. | P点时总反应的离子方程式可表示为5Fe+16H++4NO3-═3Fe2++2Fe3++4NO↑+8H2O | |
| C. | n2=0.3 | |
| D. | n3:n1=3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com