
【题目】中学化学中几种常见物质的转化关系如下图所示:
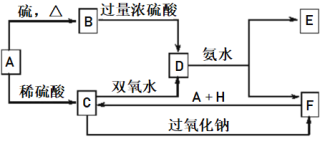
已知A是一种单质,将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)写出C的溶液与双氧水反应的离子方程式:_________________。
(2)写出鉴定E中阳离子的实验方法和现象:________________。
(3)F是一种难溶物质,其溶度积常数为1.0×10-39。向D溶液中加碱调节至pH为_______时,铁离子刚好沉淀完全(离子浓度小于1.0×10-5 mol·L-1时,即可认为该离子沉淀完全)。
(4)已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99 kJ·mol-1,单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=__________kJ·mol-1。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48L CO2气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是_____________。
【答案】2Fe2++ H2O2+2H+ = 2Fe3++ 2H2O 取少量E于试管中,加入过量氢氧化钠溶液,加热,在试管口放一湿润的红色石蕊试纸,观察到红色石蕊试纸变蓝,证明E中有NH4+存在(或用蘸浓盐酸的玻璃棒靠近,若有白烟也可) 2.7 -1185 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体,说明F为Fe(OH)3,D含有铁离子,结合转化关系,可知金属单质A为Fe、B为FeS、C为FeSO4、D为Fe2(SO4)3、E为(NH4)2SO4,H为H2SO4。据此分析解答。
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体,说明F为Fe(OH)3,D含有铁离子,结合转化关系,可知金属单质A为Fe、B为FeS、C为FeSO4、D为Fe2(SO4)3、E为(NH4)2SO4,H为H2SO4。
(1)FeSO4溶液与双氧水反应生成硫酸铁,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)鉴定(NH4)2SO4中阳离子(NH4+)的实验方法和现象为:取少量E于试管中,加入过量氢氧化钠溶液,加热,在试管口放一湿润的红色石蕊试纸,观察到红色石蕊试纸变蓝,证明E中有NH4+存在,故答案为:取少量E于试管中,加入过量氢氧化钠溶液,加热,在试管口放一湿润的红色石蕊试纸,观察到红色石蕊试纸变蓝,证明E中有NH4+存在;
(3)Fe(OH)3溶度积常数为1.0×10-39。要使铁离子刚好沉淀完全,则需要满足c(Fe3+)c3(OH-)=1.0×10-39,即c(OH-)=![]() =
=![]() ×10-11mol/L≈0.5×10-11mol/L,此时pH=2.7,故答案为:2.7;
×10-11mol/L≈0.5×10-11mol/L,此时pH=2.7,故答案为:2.7;
(4)①1mol SO2(g)氧化为1mol SO3(g) ΔH= –99 kJ·mol-1,即SO2(g)+![]() O2(g)=SO3(g) △H2=-99kJmol-1;②单质硫的燃烧热为296 kJ·mol-1,则S(s)+O2(g)=SO2(g) △H1=-296kJmol-1,根据盖斯定律将②×3+①×3可得3S(s)+
O2(g)=SO3(g) △H2=-99kJmol-1;②单质硫的燃烧热为296 kJ·mol-1,则S(s)+O2(g)=SO2(g) △H1=-296kJmol-1,根据盖斯定律将②×3+①×3可得3S(s)+![]() O2(g)=3SO3(g) △H3=3×(△H1+△H2)=-1185kJmol-1,故答案为:-1185 ;
O2(g)=3SO3(g) △H3=3×(△H1+△H2)=-1185kJmol-1,故答案为:-1185 ;
(5)4.48LCO2通入到200mL1.5mol/LNaOH溶液中,二氧化碳的物质的量=![]() =0.2mol,氢氧化钠的物质的量1.5mol/L×0.2L=0.3mol。当1<
=0.2mol,氢氧化钠的物质的量1.5mol/L×0.2L=0.3mol。当1<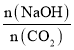 =1.5<2时,生成物是碳酸钠和碳酸氢钠,根据二氧化碳和氢氧化钠物质的量之间的关系得方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根据方程式知,碳酸钠和碳酸氢钠的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,则c(OH-)>c(H+),碳酸根离子的水解能力大于碳酸氢根离子,所以c(HCO3-)>c(CO32-),钠离子不水解,离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+
=1.5<2时,生成物是碳酸钠和碳酸氢钠,根据二氧化碳和氢氧化钠物质的量之间的关系得方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根据方程式知,碳酸钠和碳酸氢钠的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,则c(OH-)>c(H+),碳酸根离子的水解能力大于碳酸氢根离子,所以c(HCO3-)>c(CO32-),钠离子不水解,离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C三种元素在周期表中的位置如下图所示,已知A、B、C原子序数之和为37。下列关于A、B、C三种元素的说法正确的是
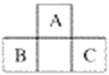
A. 元素B和C位于第四周期 B. 元素A的原子序数为7
C. 元素B最外层有5个电子 D. 元素C位于第三周期ⅤA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) KClO3+ 6HCl (浓)=3Cl2 ↑+KCl +3H2O其中氧化剂为______;还原产物为_______;氧化产物与还原产物的质量比为_________; 浓盐酸在反应中表现出来的性质是 ________ (填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)用双线桥法标出以上反应的电子转移的方向和数目___________
(3)Fe(OH)3胶体的制备:取一小烧杯,加入25 mL蒸馏水,加热至沸腾,然后向沸水中逐滴加入5 ~ 6滴___________,继续煮沸至体系呈______________,停止加热,即制得Fe(OH)3胶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A. 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂
B. 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变
C. 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图IV所示电池工作过程中,Ag2O是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4 )2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+ 2H+。请回答下列问题:
(1)取少量(NH4)2Cr2O7浓溶液于试管中,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是______________。
(2)为探究(NH4)2Cr2O7 (摩尔质量为252 g/mol)加热的分解产物,按下图连接好仪器,加热装置略去,在A中加入5.040 g样品进行实验。
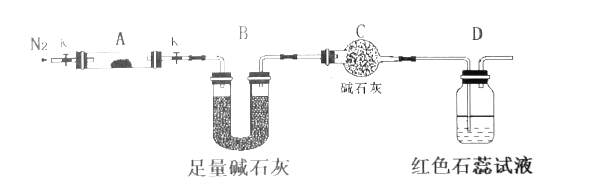
①仪器A的名称是______________。
②连接好装置,点燃酒精灯之前,先通入一段时间N2其目的为___________。
③反应结束后,依然要通一段时间的氮气的原因是________________________。
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44 g,写出重铬酸铵加热分解反应的化学方程式:____________________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为 2Ba2++Cr2O72- + H2O = 2BaCrO 4↓+2H+、4NH4++6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mo1 (CH2)6N4H+ 与 1 mo1 H+ 相当],然后用 NaOH 标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600 g,配成500 mL溶液,移取25.00 mL样品溶液于 250 mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10 mL 20.00 mol·L-1的中性甲醛溶液,摇匀、静置5 min后,加入12滴酚酞试液,用0.200 mo1 L-1 NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为16.00 mL。
①若滴定终点时,俯视读数,则测定结果_____(填“偏大” “偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. Fe与S混合加热生成FeS2
B. NaHCO3的热稳定性大于Na2CO3
C. 过量的铜与浓硝酸反应有一氧化氮生成
D. 白磷在空气中加热到一定温度能转化为红磷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间内生成nmolA2同时生成nmolAB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2nmolAB同时生成nmolB2
D.单位时间内生成nmolA2同时生成nmolB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:

(1)A元素气态氢化物的电子式___,A、B、C、D四种元素按原子半径由大到小的顺序排列为___。(填元素符号)
(2)A的最高价氧化物与氢氧化钠反应的离子方程式为___。
(3)A,C,D的最高价氧化物对应水化物的酸性强弱_______,C的氢化物比D的氢化物沸点___(填“高”或“低”),原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com