
【题目】NH3是一种重要的化工原料。
(1)不同温度、压强下.合破氦平衡休系NH3的物质的量分数如图(N2和H2的起始物质的量之比为1:3)。
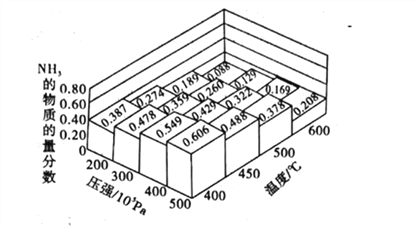
①分析图中数据,升商温度,该反应的平衡常数K值____(填“增大”“城小”或“不变”)。
②下列关于合成氨的说法正确是_____(填序号)。
A.工业上合成氨,为了提高氨的含量压强越大越好
B.使用催化剂可以提高氨气的产率
C.合成氨反应△H<0、△S<0,该反应高温条件下一定能自发进行
D.减小n(N2):n(H2)的比值,有利于提高N2的转化率
③如果开始时向密闭容器中投入1.0molN2和3.0molH2,则在500C、3×107Pa条件下达到平衡时N2的平衡转化率=_______。(保留两位有效数字)
(2)以氨气代替氢气研发氨燃料电池是当前科研的一一个热点。氨燃料电池使用的电解质溶液是KOH溶液。该电池负极的电极反应式为_________________。
(3)NH3也是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应I:NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) △H1=akJ/mol;
反应II:NH2Cl(aq)+HClO(aq)=NHCl(aq)v △H2=bkJ/mol;
反应III:2NHCl2(aq)+H2O(l)=N2(g)+HClO(aq)+3HCl(aq) △H3=ckJ/mol。
①2NH3(aq)+3HClO(aq)==N2(g)+ H2O(l) △H=________kJ/mol
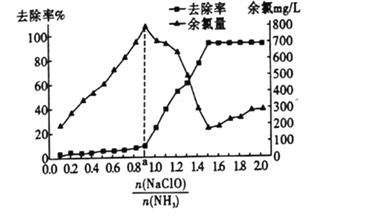
②已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件不变的情况下,改变![]() 对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
A.反应I、I I B.反应I
③除氨氮过程中最佳的![]() 值约为______________。
值约为______________。
【答案】 减小 D 41% 2NH3 6e + 6OH=N2 + 6H2O ![]() B 1.5
B 1.5
【解析】(1)①由图像可知,升高温度,氨气的物质的量分数减小,该反应为放热反应;所以升高温度,平衡左移,该反应的平衡常数K值减小;正确答案:减小。
②400℃、5×107Pa时氨气的含量最大,则![]() 转化率最高,但实际工业生产中压强不能太大,因压强太高,对生产设备要求也高,难以实现;A错误;催化剂不影响平衡移动,B错误;合成氨反应△H<0、△S<0,该反应在低温条件下一定能自发进行,高温不能,C错误;减小n(N2):n(H2)的比值,相等于增加氢气的浓度,平衡右移,有利于提高N2的转化率,D正确;正确选项D。
转化率最高,但实际工业生产中压强不能太大,因压强太高,对生产设备要求也高,难以实现;A错误;催化剂不影响平衡移动,B错误;合成氨反应△H<0、△S<0,该反应在低温条件下一定能自发进行,高温不能,C错误;减小n(N2):n(H2)的比值,相等于增加氢气的浓度,平衡右移,有利于提高N2的转化率,D正确;正确选项D。
③通过图像可知在500℃、3×107Pa条件下达到平衡时,氨气的物质的量分数为26%,设氮气的消耗量为xmol,根据反应方程式进行计算如下:
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
起始量 1 3 0
变化量 x 3x 2x
平衡量 1-x 3-3x 2x
根据氨气的物质的量分数=2x/(1-x+3-3x+2x)×100%=26%,解之x=0.41mol,所以N2的平衡转化率为41%;正确答案:41%。
(2)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3 6e + 6OH=N2 + 6H2O;正确答案:2NH3 6e + 6OH=N2 + 6H2O。
(3)①根据化学方程式和盖斯定律计算①×2 +②×2+③得到热化学方程式为2NH3(aq)+3HClO(aq)==N2(g)+ H2O(l) △H= ![]() ;正确答案:
;正确答案:![]() 。
。
②用次氯酸钠水解生成的次氯酸将水中的氨氮(用![]() 表示)转化为氮气除去,改变
表示)转化为氮气除去,改变 (即NaClO溶液的投入液),溶液中次氯酸钠去除氨氮效果与余氯图象变化中,次氯酸少氨气多,a点前发生的反应是NH3(g)+HClO(aq)==NH2Cl(aq)+H2O(l);从图象分析可以知道,反应中氨氮去除效果最佳为去除率较高同时余氯量最少,图象中符合的比值为1.5;正确答案:B;1.5。
(即NaClO溶液的投入液),溶液中次氯酸钠去除氨氮效果与余氯图象变化中,次氯酸少氨气多,a点前发生的反应是NH3(g)+HClO(aq)==NH2Cl(aq)+H2O(l);从图象分析可以知道,反应中氨氮去除效果最佳为去除率较高同时余氯量最少,图象中符合的比值为1.5;正确答案:B;1.5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 用惰性电极电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+OH-
Cl2↑+H2↑+OH-
B. 碳酸氢钠溶液与过量澄清石灰反应:HCO3-+Ca2++OH-= CaCO3↓+ H2O
C. NaHS04溶液中滴入Ba(OH)2溶液至S042-完全沉淀:2H++S042-+Ba2++ OH-= BaS04↓+2 H2O
D. 向明矾溶液中滴加过量氨水:Al3++4NH3![]() H2O=Al02-+4NH4++2H2O
H2O=Al02-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微生物作用下电解有机废水(含CH3COOH),可获得淸洁能源H2。其原理如图所示。下列有关说法不正确的是

A. 电源B极为负极
B. 通电后,若有0.1 mol H2生成,则转移0. 2 mol电子
C. 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小
D. 与电源A极相连的惰性电极上发生的反应为CH3COOH-8e-+2H2O=2CO2↑+ 8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在体积恒定的密闭容器中发生可逆反应:2SO2 (g)+ O2(g) ![]() 2SO3(g),下列不能用来判断该反应达到平衡状态的是
2SO3(g),下列不能用来判断该反应达到平衡状态的是
A. 容器中压强不再变化 B. SO2的体积分数不再变化
C. 容器中混合物的密度不再变化 D. 容器中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙呈红色的溶液中:Na+、Ba2+、Cl-、NO3-
B. c( OH-) <![]() 的溶液中:Na+、Ca2+、ClO-、NO3-
的溶液中:Na+、Ca2+、ClO-、NO3-
C. 含有大量Fe( NO3)2 的溶液中:H+、NH4+、Cl-、SO42-
D. 水电离的c( H+)= 1× 10 -13mol/L的溶液中:K+、Mg2+、Br-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是_______,其中含有_______ mol H,含有_______g O。
(2)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
②NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是(已知硝酸可将Fe2+氧化)( )
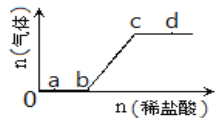
A. a点对应的溶液中:Na+、OH-、SO42-、NO3- B. b点对应的溶液中:K+、Ag+、MnO4-、NO3-
C. c点对应的溶液中:Fe2+、Ca2+、NO3-、Cl- D. d点对应的溶液中:K+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是
A. 分散系的分类:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D. 如图所示是树林中的晨曙,该反应与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“高铁出口”是中国的骄傲,高铁产业的发展也给铝工业带来了春天。最近,某大学的超导回旋加速器实验室发现了超重铝42Al,关于42Al的说法错误的是
A.属于金属元素B.中子数与质子数之差为29
C.原子的核外电子数为13D.27Al和42Al是两种不同的核素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com