
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
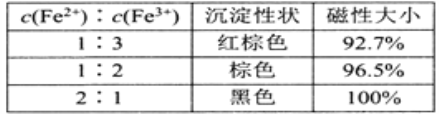
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的![]() Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:_______。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是________________。
Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:_______。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是________________。
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为__________。
(3)已知:H2O(1)=H2(g)+![]() O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
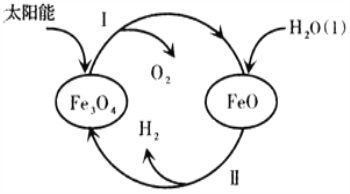
过程I.____________________________________________________。
过程II:3FeO(s)+H2O(1)===H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1。
【答案】Fe2++2Fe3++8NH3·H2O=Fe3O4↓+8NH4++4H2O Fe2+容易被氧化为Fe3+3Fe-8e-+8OH-=Fe3O4↓+2H2O2Fe3O4(s)=6FeO(s)+O2(g) △H=+313.2kJ·mo1-1
【解析】
(1)反应①中Fe2+与Fe3+物质的量比为1:2,即离子反应方程式为Fe2+与Fe3+的系数比为1:2,然后加入氨水,生成Fe3O4,即反应②离子方程式为Fe2++2Fe3++8NH3·H2O=Fe3O4+8NH4++4H2O;当c(Fe2+):c(Fe3+)=2:1时,根据表格中数据,产品磁性最大,其原因是Fe2+溶液被氧化为Fe3+;(2)不锈钢应作阳极,因为pH维持10左右,因此电解液的环境为碱性,因此生成Fe3O4的电极反应式为3Fe+8OH--8e-=Fe3O4+2H2O;(3)根据过程,Fe3O4转化成FeO和O2,方程式为2Fe3O4=6FeO+O2↑,因此用总反应减去过程II×2,得出2Fe3O4(s)=6FeO(s)+O2(g) △H=+313.2kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子。若向其中加入过氧化钠粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
A.CO32-、NO3- B.NO3-
C.SO32-、NO3- D.CO32-、NO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上氟气可作为火箭燃料中的氧化剂。1886年法国化学家H.M0issan通过电解氟氢化钾(KHF2)的氟化氢无水溶液第一次制得氟气。已知:KF+HF=KHF2,制备氟气的电解装置如图所示。下列说法错误的是
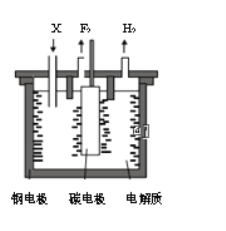
A. 钢电极与电源的负极相连
B. 电解过程需不断补充的X是KF
C. 阴极室与阳极室必须隔开
D. 氟氢化钾在氟化氢中可以电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,不一定说明木炭与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行)。
![]()
(1)若B的溶液显黄色,一定条件下B的饱和溶液可与沸水反应生成红褐色分散系
①实验室制A单质的反应的离子方程式_______________________________________;
A单质的常用检验方法____________________________
②C溶液中加入氢氧化钠溶液的现象_________________________________________;
③一定条件下W与水反应的化学方程式_______________________________________;
(2)若W为NaOH,且B为白色沉淀
①C的化学名称为______________;
②W与某金属单质也可生成C,该反应的离子方程式______________________________;
③B与W反应生成C的离子反应方程式________________________________________;
(3)若B能使品红褪色,加热又变红,C能与水反应生成一种强酸
①B转化为C的化学方程式_________________________________________________
②若A是一种化合物,A与B反应的化学方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为A12O3,含FeO杂质)为原料冶炼铝的工艺流程如下:
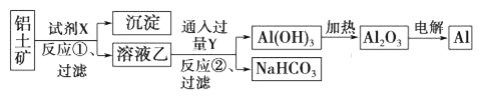
下列说法正确的是
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸溶液
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=A1(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z三种短周期元素,它们的原子序数之和等于16,X2,Y2,Z2在常温下都是无色气体,它们均为工业合成某化工产品的重要原料,其流程如下:
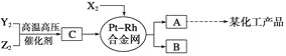
已知:①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;
②B和C分子均为常见的10电子微粒。
请回答下列问题:
(1)X元素在周期表中的位置是___________________________________________;
(2)X2与Z2可制成新型化学电源(KOH溶液作电解质溶液),两个电极均由多孔石墨制成,通入的气体在电极表面放电,负极电极反应式为________________________;
(3)化合物B吸收C后形成的溶液pH______7(填“大于”、“小于”或“等于”),其原因是(用离子方程式表示)___________________________________________________________________;
(4)写出由C生成A和B的化学方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com