
某同学中和滴定实验的过程如下:
(A)取一支碱式滴定管,
(B)用蒸馏水洗净,
(C)加入待测的NaOH溶液,
(D)记录液面刻度读数,
(E)用酸式滴定管精确放出定量标准酸液,
(F)置于未经标准酸液润洗得洁净锥形瓶中,
(G)加入适量蒸馏水,
(H)加入酚酞试液2滴,
(I)滴定时,边滴加摇荡,
(J)边注视滴定管液面的变化,
(K)当小心滴到溶液由无色变成粉红色时,停止滴定。
(L)记录液面刻度读数,
(M)根据滴定管的两次读数得出NaOH溶液体积为22mL,
指出上述实验过程中的错误之处(用编号表示)____________________。
(附:你知道各项错误的原因吗?)
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
某同学在中和滴定实验中记录数据见下表.因为时间紧迫,只做了两次实验.
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一次滴定 | 第二次滴定 | |
| 待测液HCl的体积/mL | 20.00 | 20.00 |
| 滴定终点消耗标准液NaOH的体积/mL | 23.20 | 26.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
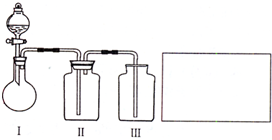 某校甲、乙、丙三个化学兴趣小组利用课外活动时间,设计了不同的课题分别进行了实验探究活动:
某校甲、乙、丙三个化学兴趣小组利用课外活动时间,设计了不同的课题分别进行了实验探究活动: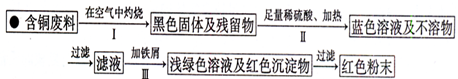

查看答案和解析>>
科目:高中化学 来源: 题型:
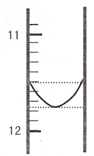 某混合碱是①Na2CO3和NaHCO3 或②Na2CO3和 NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100mol?L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和.
某混合碱是①Na2CO3和NaHCO3 或②Na2CO3和 NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100mol?L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和.| 序号 | 第一滴定终点的读数(V1/mL) | 第二滴定终点的读数(V2/mL) |
| I | ? | 26.85 |
| II | 10.02 | 25.02 |
| III | 9.98 | 24.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com