


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源:2013届浙江省宁海县知恩中学高三第二次阶段性考试化学试卷(带解析) 题型:单选题
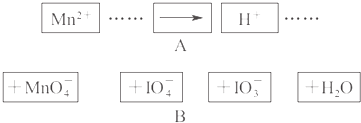
把图2中的物质补充到图1中,可得到一个完整的氧化还原反应离子程式(未配平)。对该氧化还原反应离子方程式的说法不正确的是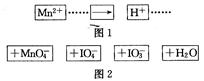
A.IO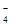 作氧化剂 作氧化剂 |
| B.氧化剂和还原剂的物质的量之比为5:2 |
| C.若有2mol Mn2+参加反应,则转移10 mol电子 |
| D.配平后Mn2+、H+的化学计量数分别为2、3 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三第二次阶段性考试化学试卷(解析版) 题型:选择题
把图2中的物质补充到图1中,可得到一个完整的氧化还原反应离子程式(未配平)。对该氧化还原反应离子方程式的说法不正确的是
A.IO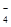 作氧化剂
作氧化剂
B.氧化剂和还原剂的物质的量之比为5:2
C.若有2mol Mn2+参加反应,则转移10 mol电子
D.配平后Mn2+、H+的化学计量数分别为2、3
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省高三9月调研考试化学试卷(解析版) 题型:选择题
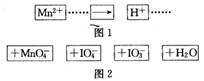
把图2中的物质补充到图1中,可得到一个完整的氧化还原反应离子方程式(未配平)。对该氧化还原反应离子方程式的说法不正确的是( )
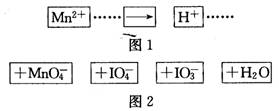
A.IO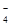 作氧化剂
作氧化剂
B.氧化剂和还原剂的物质的量之比为5:2
C.若有2mol Mn2+参加反应,则转移10 mol电子
D.配平后Mn2+、H+的化学计量数分别为2、3
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把图b中的物质补充到图a中,可得到一个完整的氧化还原型离子方程式(未配平).对该氧化还原型离子方程式说法不正确的是

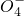 作氧化剂
作氧化剂查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com