
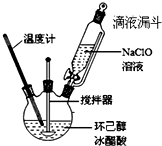
 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.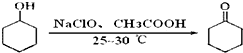
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 26 | 160.8 | 可溶于水 |
| 环己酮 | -45 | 155.6 | 微溶于水 |
| 冰醋酸 | 16.6 | 117.9 | 可溶于水 |
分析 (1)酸性Na2Cr2O7溶液应缓慢加入,防止剧烈反应导致温度过高,也可以进行冰水浴等;
(2)NaClO和CH3COOH反应生成次氯酸与醋酸钠,醋酸、次氯酸为弱电解质,写成化学式形式;
(3)用亚硫酸氢钠除去过量的NaClO;用饱和食盐水可降低有机物在水层中溶解度;分液时用到的玻璃仪器有分液漏斗、烧杯;
(4)液体加热需要防止暴沸;使用滴液漏斗可以使漏斗内液体顺利流下;
(5)根据环己醇计算理论上得到环己酮的质量,产率=$\frac{实际产量}{理论产量}$×100%;
(6)目的是除去NaClO,可以用KI淀粉试纸检验溶液中是否含有NaClO.
解答 解:(1)合成环己酮的反应是放热反应,酸性Na2Cr2O7溶液应缓慢加入,防止剧烈反应导致温度过高,减少副反应发生,也可以分次加入酸性Na2Cr2O7溶液,或者利用冰水浴冷却,
故答案为:控制滴加速度、冰水浴等;
(2)NaClO和CH3COOH反应生成次氯酸与醋酸钠,醋酸、次氯酸为弱电解质,反应离子方程式为:ClO-+CH3COOH=HClO+CH3COO-,
故答案为:ClO-+CH3COOH=HClO+CH3COO-;
(3)NaHSO3具有还原性,可以除去过量的NaClO;用饱和食盐水,减小环己酮的溶解度,有利于液体分层;分液时用到的玻璃仪器有分液漏斗、烧杯,
故答案为:除去过量的NaClO;减小环己酮的溶解度;分液漏斗、烧杯;
(4)加入沸石的作用是防止暴沸,上述实验中使用到滴液漏斗,平衡装置内压强,使漏斗内液体顺利流下,
故答案为:防止暴沸;可以使漏斗内液体顺利流下;
(5)0.05mol环己醇理论上得到环己酮为0.05mol×98g/mol=4.9g,所以产率是$\frac{2.94g}{4.9g}$×100%=60%,
故答案为:60%;
(6)加入NaHSO3溶液目的是除去过量的NaClO,加入的饱和NaHSO3溶液已经足量的实验方案为:取一段KI淀粉试纸于表面皿上,用玻璃棒蘸取反应液点试纸中央,若不变蓝,则NaHSO3溶液已足量,
故答案为:取一段KI淀粉试纸于表面皿上,用玻璃棒蘸取反应液点试纸中央,若不变蓝,则NaHSO3溶液已足量.
点评 本题考查有机物的制备实验,涉及对操作的分析评价、物质的分离提纯、产率计算、实验方案设计等,难度中等,是对学生综合能力的考查.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
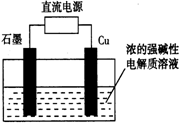 Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A. | 石墨电极上产生氢气 | B. | 铜电极发生还原反应 | ||
| C. | 铜电极接直流电源的负极 | D. | 该反应也可设计为原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m:n=2:1 | B. | m=2x | C. | x:m:n=1:2:1 | D. | m=2x+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ka=1.8×10-5 |
| H2SO3 | Ka1=1.23×10-2 Ka2=6.6×10-8 |
| NH3.H2O | Kb=1.8×10-5 |
| A. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的 | |
| B. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(2H)原子核内有1个质子 | |
| B. | 1H与2H是不同的核素 | |
| C. | 1H218O与2H216O的相对分子质量相同 | |
| D. | 1H2O与2H2O互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过渡元素中,可以找到半导体材料 | |
| B. | 在ⅠA、ⅡA族元素中,寻找制造农药的主要元素 | |
| C. | 在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料 | |
| D. | 为元素性质的系统研究提供指导,为新元素的发现提供线索 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液:Mg2+、Na+、NO3-、Cl- | |
| B. | 0.1mol•L-1NH4Cl溶液:K+、Ba2+、OH-、CO32- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、I- | |
| D. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 11g分子式为C3H8的链烃中含有的C-H的数目为2NA | |
| C. | 室温时,1.0L pH=13的 Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com