
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
科目:高中化学 来源:不详 题型:填空题
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%, | A.1 | B.2 | C.3 | D.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可逆反应的特征是正反应速率和逆反应速率相等 |
| B.对已达到化学平衡的反应仅改变浓度,若平衡移动,则平衡常数(K)一定不变。 |
| C.电镀时应把镀件置放电解槽的阳极。 |
| D.电解AlCl3来制取金属铝。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
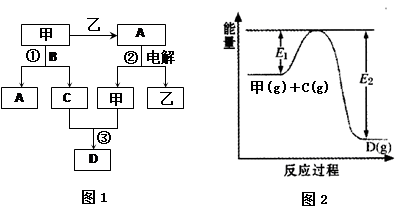
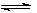 CH3OH(g) + H2O(g) △H=" -49.0" kJ·mol-1
CH3OH(g) + H2O(g) △H=" -49.0" kJ·mol-1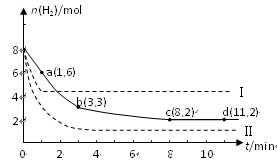
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
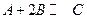 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为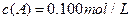 、
、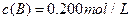 及
及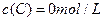 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。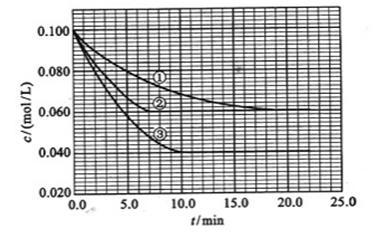

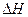 >0,判断其理由是________________;
>0,判断其理由是________________;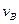 =___________;
=___________; =_______________。
=_______________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
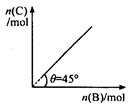
 4C(g) + D ( g );△H < 0 。
4C(g) + D ( g );△H < 0 。A.平衡 时B的转化率为33.3 % 时B的转化率为33.3 % |
| B.若再加入B,则再次达到平衡时正.逆反应速率均增大,但仍然相等 |
| C.若再加人4molC和1molD ,则再次达到平衡时体系气体密度减小,平均摩尔质量不变 |
| D.若温度变为(t+10)℃,则θ<45° |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com