
【题目】下列关于化学反应与能量的说法正确的是 ( )
A. 放热反应在常温下一定很容易发生
B. 化学反应一定既伴随着物质变化又伴随着能量变化
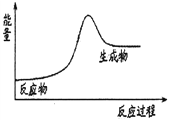
C. 石灰石分解反应的能量变化可以用右图3表示
D. 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究。完成下列空格。
①提出假设:
假设1:只存在Fe2O3;假设2:_________;假设3:既存在Fe2O3也存在Cu2O。
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设____不成立,写出产生上述气体的化学方程式___________________。
步骤二:取少量步骤一溶液置于试管中滴加_______,振荡,若________,则说明假设3成立。
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设_不成立。
方案三:

同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案________(填“能”或“不能”)测出矿物中Fe2O3的质量分数。不改变装置和药品,通过计算得出矿物中Fe2O3的质量分数,你还可以通过测定_______。若测得m1为3.04g,m3=m2+1.76g,则原样品中Fe2O3的质量分数为_____(结果保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
①天然气②煤③核能④水力发电⑤太阳能⑥燃料电池⑦风能⑧氢能
A. ①②③④ B. ③⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的正确判断的是
A.在pH=12的溶液中,Al3+、Cl-、HCO3-、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存
C.由0.1 mol/L —元碱BOH溶液的pH=10,可推知BOH溶液存在BOH![]() B++OH-
B++OH-
D.pH =2的一元酸和pH =12的一元强碱等体积混后溶液一定存在:c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2分)N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l)△H=+257kJmol﹣1
N2(g)+H2O(l)△H=+257kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解饱和食盐水的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是
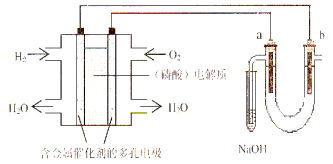
A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH-
B.电解时,a 电极周围首先放电的是Cl—
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.2g H2 时,b极周围会产生2.24L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空。
族 周期 | ⅠA | 0 | ||||||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
2 | X | Y | G | |||||||||||
3 | Z | …… | H | W | E | Q | ||||||||
(1)上述元素的原子中,得电子能力最强的是______________(填元素名称)。
2)化学性质最不活泼的是___________(填元素符号)。
(3)G对应离子的半径______________Z对应离子的半径(填“<”或“>”)。
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:________________。
(5)元素X的最高价氧化物的电子式________________,元素W的最高价氧化物为
_______________(填晶体类型)。
(6)为比较元素X和W的非金属性强弱,用下图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B的作用是________________,能说明X和W非金属性强弱的化学方程式是_________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是:
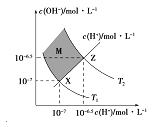
A. 两条曲线间任意点均有c(H+)×c(OH-)=KW
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据水溶液中离子平衡的知识回答下列问题:
I.已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则
(1)该溶液中c (H+)=________,HA的电离平衡常数Ka=________;
(2)由HA电离出的c(H+)约为水电离出的c (H+)的________倍。
II.常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同,则:B是________,C是________。常温下若B溶液中c(OH-)与C溶液中c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=________(填某个数)。
III.将pH=1的稀硫酸慢慢加入一定量的BaCl2溶液中,恰好使Ba2+沉淀完全时溶液的体积为100 mL(混合时溶液体积变化忽略不计),溶液的pH=2,则原BaCl2 溶液中Cl-的浓度为 mol/L。(结果保留两.位.有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com