
分析 设一氯代烃为R-Cl,与氢氧化钠发生反应:R-Cl+NaOH$→_{△}^{水}$R-OH+NaCl,反应消耗NaOH为0.5L×0.1mol/L=0.05mol,则一氯代烃的物质的量为0.05mol,故烃A的物质的量为0.05mol,则烃A的相对分子质量为$\frac{3.6}{0.05}$=72,由于$\frac{74}{14}$=5…2,属于烷烃,故烃A的分子式为C5H12,若烃的一氯代物只有一种,该烃分子中只有一种氢原子,故为新戊烷.
解答 解:(1)设一氯代烃为R-Cl,与氢氧化钠发生反应:R-Cl+NaOH$→_{△}^{水}$R-OH+NaCl,反应消耗NaOH为0.5L×0.1mol/L=0.05mol,则一氯代烃的物质的量为0.05mol,故烃A的物质的量为0.05mol,则烃A的相对分子质量为$\frac{3.6}{0.05}$=72,
故答案为:72;
(2)由于$\frac{74}{14}$=5…2,属于烷烃,故烃A的分子式为C5H12,可能结构简式有:CH3CH2CH2CH2CH3,CH3CH2CH(CH3)2,C(CH3)4,
故答案为:C5H12;CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4;
(3)若烃A的一氯代物只有一种,该烃分子中只有一种氢原子,故结构简式为C(CH3)4,名称为2,2-二甲基丙烷,
故答案为:C(CH3)4;2,2-二甲基丙烷.
点评 本题考查有机物推断,注意结合相对分子质量利用商除法确定分子式,掌握有机物命名,难度不大.


科目:高中化学 来源: 题型:选择题
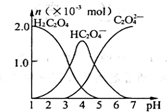 常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是| A. | HC2O4-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10 mL,时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15 mL,时,溶液中存在:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20 mL,时,溶液中存在:c(OH-)=c(HC2O4-)+2c(H2C2O4)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1mol•L-1 | 0.05mol•L-1 | 3.5 |
| 2 | 0.1mol•L-1 | 0.1mol•L-1 | x |
| 3 | 0.2mol•L-1 | 0.2mol•L-1 | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
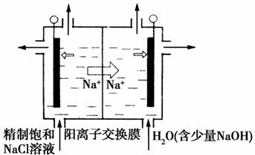 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜与烧碱溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸钠溶液中加入足量盐酸:Na2CO3+2H+═Na++CO2↑+H2O | |
| D. | 氢氧化铝中和胃酸(盐酸):Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
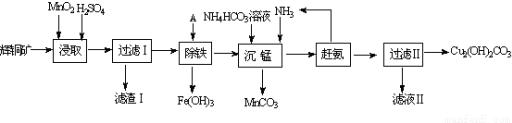
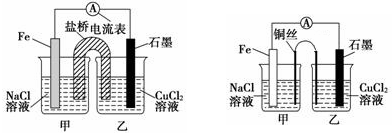
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com