
分析 根据n=$\frac{m}{M}$分别计算出62.0kg二氧化碳、49.0kg氧气的物质的量,然后根据V=nVm计算出标准状况下二氧化碳、氧气的体积,据此进行解答.
解答 解:62.0kg二氧化碳气体的物质的量为:$\frac{62×1{0}^{3}g}{44g/mol}$=1.41×103mol,标准状况下该二氧化碳的体积为:22.4L/mol×1.41×103mol=3.16×104L;
49.0kg氧气的物质的量为:$\frac{49.0×1{0}^{3}g}{32g/mol}$=1.53×103mol,标准状况下该氧气的体积为:22.4L/mol×1.53mol=3.43×104L,
故答案为:3.16×104;34.3.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
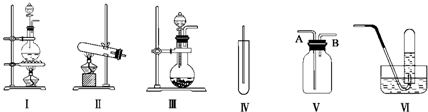
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
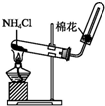
| A. | 氨和铵盐都易溶于水,都能生成NH4+ | |
| B. | 铵态氮肥与碱性物质如草木灰混合施用肥效更高 | |
| C. | 实验室制备氨气的试剂和装置可为如图装置 | |
| D. | 工业上用氨气液化需吸收热量的过程做制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
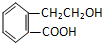 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
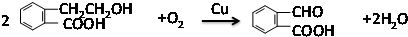 ;氧化反应;
;氧化反应; ;酯化反应;
;酯化反应; $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
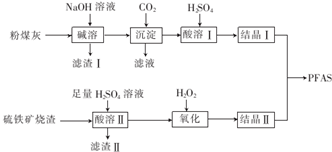
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
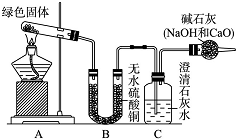 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 1mol碳正离子CH3+所含的电子数为6NA | |
| C. | 室温下的乙烯和丁烯共21.0g,其中碳原子数为1.5NA | |
| D. | 标准状况下,1L 庚烷完全燃烧后,所生成的气态产物分子数为$\frac{7}{22.4}$NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com