
| A. | 稀硫酸 | B. | 乙醇 | C. | 稀硝酸 | D. | 氢氧化钠溶液 |
分析 A.铜丝灼烧变黑生成氧化铜,氧化铜与稀硫酸反应完全溶解;
B.铜做乙醇催化氧化的催化剂,反应前后质量不变;
C.铜丝灼烧变黑生成氧化铜,氧化铜与稀硝酸反应完全溶解;
D.铜丝灼烧变黑生成氧化铜,氧化铜与氢氧化钠溶液不反应.
解答 解:A.铜丝灼烧变黑生成氧化铜,氧化铜与稀硫酸反应完全溶解,质量减少,故A不选;
B.铜丝灼烧变黑生成氧化铜,氧化铜能够氧化乙醇生成铜、乙醛,铜在反应中做催化剂,质量前后不变,故B选;
C.铜丝灼烧变黑生成氧化铜,氧化铜与稀硝酸反应完全溶解,质量减少,故C不选;
D.铜丝灼烧变黑生成氧化铜,氧化铜与氢氧化钠溶液不反应,铜丝质量增重,故D不选;
故选:B.
点评 本题考查了铜的性质、乙醇的催化氧化反应,明确铜在乙醇催化氧化反应中作用是解题关键,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
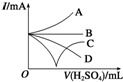 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2溶液的pH大于7 | B. | 用HNO2溶液作导电试验,灯泡很暗 | ||
| C. | HNO2不跟NaCl反应 | D. | 可以使石蕊试剂变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 变浅 | C. | 变深 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中和10ml 0.1 mol•L-1醋酸与中和100ml 0.01 mol•L-1醋酸所需同种碱溶液的量不同 | |
| B. | 体积相等、pH相等盐酸和硫酸溶液中,H+离子的物质的量相等 | |
| C. | 等体积pH=3的酸溶液与pH=11的碱溶液相混合后,混合溶液的pH一定等于7 | |
| D. | 250C时,将0.1 mol•L-1NaOH溶液与pH=1的稀硫酸等体积混合,混合后溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40g NaOH溶于1L 水所得的溶液 | |
| B. | 将0.5mol•L-1的NaNO3溶液100mL 加热蒸发掉50g水所得的溶液 | |
| C. | 将23g Na 溶于水并配成1L的溶液 | |
| D. | 含K+为2mol的K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
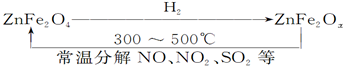
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:2 | |
| B. | 若有1mol电子转移,则氧化产物的物质的量是0.5mol | |
| C. | 据此反应原理,可以在酸性条件下用淀粉碘化钾试纸检验NO${\;}_{2}^{-}$的存在 | |
| D. | 若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com