
【题目】已知次磷酸(H3PO2)为一元酸,欲证明它是弱电解质,下列操作方法不正确的是
A. 用物质的量浓度相同的NaCl溶液和NaH2PO2溶液进行导电性实验,比较灯泡的亮度
B. 用一定浓度的NaOH溶液分别滴定等体积、等pH的盐酸和次磷酸溶液,比较消耗碱液的体积
C. 加热滴有酚酞试液的NaH2PO2溶液,溶液颜色变深
D. 常温下,稀释0.1mol·L-1次磷酸溶液至原溶液体积的100倍,测得pH在4~5之间
【答案】A
【解析】
A. NaCl 和NaH2PO2都属于强电解质,所以用物质的量浓度相同的溶液和溶液进行导电性实验,比较灯泡的亮度不能证明NaH2PO2是弱电解质,故A错误;B. 因HCl为强酸,若滴定时次磷酸溶液消耗NaOH溶液的体积大于等体积、等pH的盐酸消耗的NaOH溶液体积,则说明次磷酸为弱电解质, B正确;C.若次磷酸为弱电解质,则NaH2PO2溶液呈碱性,加热促进水解,溶液颜色变深,C正确; D.常温下,若次磷酸为一元强酸,则把0.1 mol![]() L-1次磷酸溶液稀释至原溶液体积的100倍,pH应为3,而现测得pH在4~5之间,说明次磷酸没有完全电离,为弱电解质,D正确. 答案:A。
L-1次磷酸溶液稀释至原溶液体积的100倍,pH应为3,而现测得pH在4~5之间,说明次磷酸没有完全电离,为弱电解质,D正确. 答案:A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 实验操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液。 | 试管A、B中均未明显见到有气泡产生。 |
(1)实验①的目的是___________________________________________,实验中滴加FeCl3溶液的目的是________________________________。
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是________________________________________________________(用实验中所提供的几种试剂)。
(3)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图甲所示,则A、B、C三点所表示的瞬时反应速率最慢的是_____________。
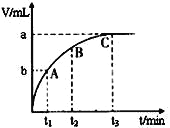
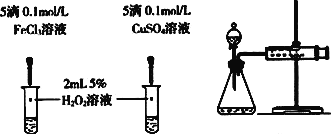
甲 乙 丙
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图乙、丙所示的实验。请回答相关问题:
①定性如图乙可通过观察_________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______________________________________。
②定量用图丙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是______________________________。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________方法的应用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H= - 890.0kJ/mol
(2)2C2H6(g)+7O2(g)==4CO2(g)+6H2O(l) △H= - 3119.6kJ/mol
(3)C2H4(g)+3O2(g)==2CO2(g)+2H2O(l) △H= - 1411.0kJ/mol
(4)2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) △H= - 2599.2kJ/mol
(5)C3H8(g)+5O2(g)==3CO2(g)+4H2O(l) △H= - 2219.9kJ/mol
现有由上述五种烃中的两种组合成的混合气体2mol,经充分燃烧后放出2970.8kJ热量,则下列哪些组合是不可能的 ( )
A. CH4和C3H8 B. C2H4和C3H8 C. C2H6和C3H8 D. C2H6和CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若甲不变,将乙蒸发掉一半水(溶质不析出),丙中通入一定量的CO2 。然后以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是
A. V甲=V乙>V丙 B. V丙>V乙>V甲 C. V乙>V丙>V甲 D. V甲=V乙=V丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积固定的密闭容器中,发生可逆反应A(s) +3B(g)![]() 3C(g)。下列叙述中能表明该可逆反应一定达到平衡状态的有( )
3C(g)。下列叙述中能表明该可逆反应一定达到平衡状态的有( )
①C的生成与分解速率相等 ②单位时间内生成amolA和3amolB
③B的浓度不再变化 ④混合气体总物质的量不再变化
⑤A、B、C的物质的量之比为1:3:3 ⑥混合气体的密度不再变化
⑦A的浓度不再变化 ⑧混合气体的颜色不再变化
⑨混合气体的平均相对分子质量不再变化
A. 6个B. 5个C. 4个D. 3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中![]() =________。
=________。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=________。该温度________(填“高于”或“低于”)25 ℃。
(3)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =________。
=________。
(4)常温下,pH=13的Ba(OH)2溶液a L与pH=3的H2SO4溶液b L混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=________。
若所得混合溶液pH=12,则a∶b=________。
(5)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=________。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )
2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )

A. t5~t6时氨气的体积分数最大 B. t3时升高了温度
C. t1时加入催化剂 D. t4时减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式或离子方程式正确的是
A. NaHCO3电离:NaHCO3=Na++H++CO32-
B. NH4+水解:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
C. H3PO4电离:H3PO4====3H++PO43-
D. CO32-水解:CO32-+H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com