
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |
分析 (1)相同条件下,酸的电离平衡常数越小,其越难电离,其酸根越容易结合氢离子;三种物质都是盐溶液,根据越弱越水解进行判断;
(2)由于酸性:HCN>NaHCO3,则NaCN溶液中通入少量二氧化碳生成碳酸氢钠和HCN;
(3)向稀氨水中加入等体积等浓度的醋酸溶液,两者恰好完全反应,生成醋酸铵,因为醋酸和氨水的电离度相同,所以醋酸铵溶液呈中性;
(4)弱电解质溶液中,弱电解质的浓度越大,其电离程度越小,浓度越小,其电离程度越大.
解答 解:(1)相同条件下,酸的电离平衡常数越小,其越难电离,其酸根越容易结合氢离子,所以CH3COO-、CN-、CO32-结合质子的能力大小顺序是CO32->CN->CH3COO-;
已知酸性:CH3COOH>H2CO3>HCN,则根据越弱越水解可知,水解程度越大,pH越大,相同条件下,浓度相同的五种溶液的pH由大到小的顺序为②③①;
故答案为:CO32->CN->CH3COO-;②③①;
(2)由于酸性:HCN>NaHCO3,则NaCN溶液中通入少量二氧化碳生成碳酸氢钠和HCN,则反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-;
故答案为:CN-+CO2+H2O=HCN+HCO3-;
(3)向稀氨水中加入等体积等浓度的醋酸溶液,两者恰好完全反应,生成醋酸铵,因为醋酸和氨水的电离度相同,所以醋酸铵溶液呈中性,而水解极其微弱,所以离子浓度大小为:c(CH3COO-)=c(NH4+)>c(H+)=c(OH-),故答案为:c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
(4)一水合氨是弱电解质,在溶液里存在电离平衡,氨水的浓度越大,一水合氨的电离程度越小,浓度越小,一水合氨的电离程度越大,甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,由弱电解质的浓度越小,电离程度越大,故甲瓶氨水的电离度比乙瓶氨水的电离度小,所以甲、乙两瓶氨水中[OH-]之比小于10,故答案为:<.
点评 本题考查弱电解质的强弱与水解的关系,并利用电离与水解来分析溶液中的离子的浓度的关系,学生应明确电离平衡常数的应用来解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 开始时A容器中的反应速率大于B容器中的反应速率 | |
| B. | 平衡时c(I2)A=c(I2)B | |
| C. | HI的平衡分解率:αA>αB | |
| D. | 平衡时,I2蒸气在混合气体中的体积分数:A容器>B容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有一种甲醇质子交换膜燃料电池,电池的结构示意图如图,则下列有关说法不正确的是( )
有一种甲醇质子交换膜燃料电池,电池的结构示意图如图,则下列有关说法不正确的是( )| A. | 电极c是电池的负极 | |
| B. | 每消耗1mol甲醇转移的电子数为3NA | |
| C. | 电极d的反应式为:4H++O2+4e-=2H2O | |
| D. | 电极c的反应式为:CH3OH+H2O-6e-=CO2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=1.6 mol•(L•min)-1 | B. | v(NO2)=0.9 mol•(L•min)-1 | ||
| C. | v(N2)=0.25mol•(L•min)-1 | D. | v(CO2)=1.2 mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 明矾能够净水,是因为明矾水解生成的Al(OH)3胶体能杀死水中的细菌 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 提倡人们购物时不用塑料袋,是为了节约资源,减少白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
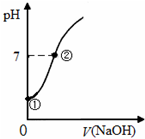 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HClO的电离平衡 | |
| B. | ①到②水的电离程度逐渐减小 | |
| C. | I-能在②点所示溶液中存在 | |
| D. | ②点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com