
常温下,将等浓度的FeSO4和(NH4)2SO4两种浓溶液混合可制得一种晶体,该晶体是分析化学中常用的一种还原剂,其强热分解反应化学方程式:
2(NH4)2Fe(SO4)2·6H2O![]() Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O。下列说法正确的是
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O。下列说法正确的是
A.该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3
B.1mol摩尔盐强热分解时转移电子的物质的量为8NA
C.向摩尔盐溶液中滴入足量浓NaOH溶液,最终可得刺激性气体和白色沉淀
D.常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4小
科目:高中化学 来源: 题型:阅读理解
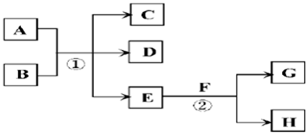
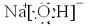
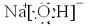
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com