
����Ŀ���Ҵ�����Ϊ21���͵�����ɫ��Դ��������ú�����Ṥ�ճ��졢�ɱ�����������������Ҵ��нϴ�ļ۸���˿�չ����������Ҵ��Ĵ���Ӧ�о�������Ҫ���塣�ش���������:
��1������������Ҵ���һ�����ӵķ�Ӧ��ϵ����ͬ�ķ�Ӧ�����ᵼ���γɲ�ͬ�IJ�Ʒ�ֲ�����Ҫ��Ӧ��������:
��Ӧ��CH3COOH(g) + H2(g)��CH3CHO(g) +H2O(g) H1
��Ӧ��CH3CHO(g) +H2(g) ��CH3CH2OH(g) ��H2
���ָ���Ӧ����:
��Ӧ��CH3CH2OH(g) + CH3COOH(g)��CH3COOCH2CH3(g) +H2O(g) H3
��Ӧ��CH3COOCH2CH3(g) +2H2(g) ��2CH3CH2OH(g) H4
H4=___ (��H1����H2�� H3��ʾ)��
��2������������Ҵ��ķ�Ӧ�ɱ�ʾΪCH3COOH(g) + 2H2(g)==CH3CH2OH(g) + H2O(g) H<0������߸÷�Ӧ�������ƽ��ת���ʣ��ɲ�ȡ��������ʩ��_________���������������������( ����Ӧ)�Ļ�ѧ����ʽ�ɱ�ʾΪ____________.
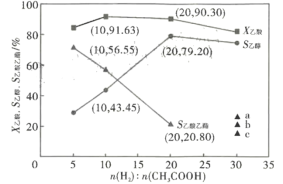
��3���ں���2609��C�� ��ѹ1.4MPa, ԭ������һ��������ͨ��ij������������������Ҵ��ȷ�Ӧ����/��(���ʵ���)Ͷ�ϱȶԷ�Ӧ��Ӱ����ͼ��ʾ��X������ʾ�����ת����, S�Ҵ���S���������ֱ��ʾ�Ҵ�������������ѡ���ԣ����У�S�Ҵ�=![]() ��S��������=
��S��������=![]() ������ͼ�����ݷ����������/��Ͷ�ϱ�ֵ��_______________,�������£�������Ӧ��____________(������������������)���е��ף�������____________ ;����ͼ�����߱仯���ɣ��ж���/��Ͷ�ϱ�=30ʱ��S�����������������������ͼ��a��b��c�е�______��;��/��Ͷ�ϱ�=20ʱ������H2��ת����=_______. ( �г�����ʽ���ɣ���ͬ),�Ҵ��ķ�ѹP�Ҵ�=__________(��ѹ=��ѹ�����ʵ�������)��
������ͼ�����ݷ����������/��Ͷ�ϱ�ֵ��_______________,�������£�������Ӧ��____________(������������������)���е��ף�������____________ ;����ͼ�����߱仯���ɣ��ж���/��Ͷ�ϱ�=30ʱ��S�����������������������ͼ��a��b��c�е�______��;��/��Ͷ�ϱ�=20ʱ������H2��ת����=_______. ( �г�����ʽ���ɣ���ͬ),�Ҵ��ķ�ѹP�Ҵ�=__________(��ѹ=��ѹ�����ʵ�������)��
���𰸡�H1+H2-H3 �����¶ȡ�����ѹǿ������������Ũ�ȡ���С����Ũ�� 2CH3COOH(g) + 2H2(g) ��CH3COOCH2CH3(g) +2H2O(g) 20 �� �Ҵ�������������ѡ����֮��Ϊ100%��˵������ȩ���ɣ�����Ӧ���ܽ��е��� a 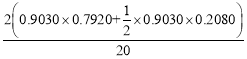 ��100%
��100% 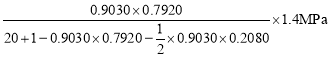
��������
(1)���ݸ�˹���ɣ���Ӧ��+��-�۵÷�Ӧ�ܣ�����H4=H1+H2-H3��
(2)�÷�ӦH<0��Ϊ���ȷ�Ӧ�����Խ����¶ȿ�ʹƽ���������������ת���ʣ���������������Ҳ����ʹƽ������ͬʱ���������ת���ʣ��÷�ӦΪѹǿ��С�ķ�Ӧ���Լ�ѹ����ʹƽ���������������ת���ʣ���ʱ�������������ʹƽ�����ƣ����������ת���ʣ������������������ת���ʿ��ԣ������¶ȡ�����ѹǿ������������Ũ�ȡ���С����Ũ�ȣ��������������Ӧ�����Ҵ����Ҵ������ᷴӦ�������������������ܵķ�Ӧ����ʽΪ��2CH3COOH(g) + 2H2(g) ��CH3COOCH2CH3(g) +2H2O(g)��
(3)�÷�Ӧ��Ŀ������ȡ�Ҵ�����ͼ��֪����/��Ͷ�ϱ�ֵ��20ʱ�������ת���ʽϸߣ�ͬʱ�Ҵ���ѡ���Խϴ�
��ͼ��֪��Ͷ�ϱ�������Ҵ�������������ѡ����֮��Ϊ100%��˵������ȩ���ɣ�����Ӧ���ܽ��е��ף�
Ͷ�ϱ���20��Ϊ30ʱ��S�Ҵ���С������Ӧ��������ֻ���Ҵ�����������������������ѡ�����½���������������ѡ����Ӧ����������Ӧ������a�㣻
Ͷ�ϱ�Ϊ20�������ʼͶ��Ϊ��20mol������1mol���ᣬ��ʱ�����ת��Ϊ90.30%������Ӧ����0.9030mol�������ɵ��Ҵ������ʵ���Ϊn�Ҵ�=n������S�Ҵ�=0.9030��0.7920mol�����ɵ��������������ʵ���n��������=n������![]() S��������=
S��������=![]() ��0.9030��0.2080mol�����ݷ�����������Ӧ��
��0.9030��0.2080mol�����ݷ�����������Ӧ��
(��)CH3COOH(g) + 2H2(g)![]() CH3CH2OH(g) + H2O(g)
CH3CH2OH(g) + H2O(g)
(��)2CH3COOH(g) + 2H2(g) ��CH3COOCH2CH3(g) +2H2O(g)
��֪�����ĵ����������ʵ���Ϊ2(n��������+n�Ҵ�)=2(0.9030��0.7920mol+![]() ��0.9030��0.2080mol)����ת����Ϊ
��0.9030��0.2080mol)����ת����Ϊ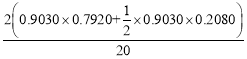 ��100%��
��100%��
����������Ӧ��Ϊ�������ʵ�����С�ķ�Ӧ���ɷ���ʽ��֪n��=n�Ҵ�=0.9030��0.7920mol��n��=n��������=![]() ��0.9030��0.2080mol����Ӧ�������ܵ����ʵ���Ϊn��=(20+1-0.9030��0.7920-
��0.9030��0.2080mol����Ӧ�������ܵ����ʵ���Ϊn��=(20+1-0.9030��0.7920-![]() ��0.9030��0.2080)mol�����ݷ�ѹ=��ѹ�����ʵ���������֪p�Ҵ�=p����
��0.9030��0.2080)mol�����ݷ�ѹ=��ѹ�����ʵ���������֪p�Ҵ�=p����![]() =
=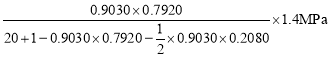 ��
��


 ��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�

�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90��������30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺����ؽᾧ�ò��ᾧ�壬������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%���������������ǣ�_________��
��2��ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
��3����������Ƿ�ˮ����ȫ���õ��Լ�Ϊ_________��
��4�������ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ȡ����Ʒ0.12g��������ˮ��ȫ�ܽ⣬Ȼ����0.020molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ������ʱ��Һ��ɫ�仯Ϊ_________���ζ�ǰ��ζ����е�Һ�������ͼ2��ʾ����ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת����ϵ���ش����⣺

��֪������CH3Br![]() CH3��HBr��
CH3��HBr��
��C���ʱ�����һ±����ֻ�����֡�
(1)д��B���ʵ�����__________��D���ʵĽṹ��ʽ________��
(2)д����Ӧ��������________����Ӧ��������________��
(3)д����Ӧ���Ļ�ѧ����ʽ��________________________________��
(4)д��D��E��Ӧ�Ļ�ѧ����ʽ��_______________��
(5)��Ӧ�����п�������һ��C16H18���л���䱽����һ±����Ҳֻ�����֣�д�����Ľṹ��ʽ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��O��Na��Cl��Fe��Cu��Ԫ�����ڱ�ǰ�������еij���Ԫ�ء�
(1)Fe��Ԫ�����ڱ��е�λ����_____��Cu��̬ԭ�Ӻ�������Ų�ʽΪ________��
(2)C��O����̬�⻯���У����ȶ�����________��д��ѧʽ����C�ĵ縺�Ա�Cl��________�����С������
(3)д��Na2O2��CO2��Ӧ�Ļ�ѧ����ʽ____________________________��
(4)̼�ж���ͬ�������壬����ʯīϩ����ʯ�ľ���ṹ��ͼ��ʾ��
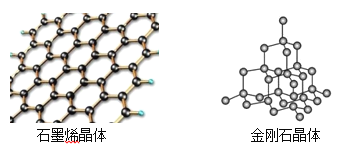
����ʯīϩ�����У�ÿ��Cԭ������___________����Ԫ����ÿ����Ԫ��ռ��___________��Cԭ�ӡ�
���ڽ��ʯ�����У�Cԭ�������ӵ���С��ҲΪ��Ԫ����ÿ��Cԭ������__________����Ԫ������Ԫ���������_________��Cԭ����ͬһƽ�档
(5)��ʴӡˢ��·�ķ�Һ�к��д�����CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ�Ϊ��ʹFeCl3ѭ�����úͻ���CuCl2�����չ������£�

���Լ�X�Ļ�ѧʽΪ______________��
����������1 L��Һ�к�CuCl2��FeCl2��FeCl3�����ʵ���Ũ�Ⱦ�Ϊ0.5 mol��L��1�������Cl2������X���ˡ�Ϊʹ��Һ��Ԫ����ȫת��ΪFe(OH)3����CuCl2 ��������������Ӧ����pH�ķ�Χ��____________________________������Һ������ֲ��䣩����֪��Ksp[Fe(OH)3]��1.0��10��38��Ksp[Cu(OH)2]��2.0��10��20��lg5��0.7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��л��������˵���������
A.�����Ǻ͵��ۻ�Ϊͬϵ��
B.ֲ���ͺ�������֬������������������ӳɺ����ɹ�̬������֬��
C.��������(![]() )��������ͬһֱ���ϵ�ԭ�������8��
)��������ͬһֱ���ϵ�ԭ�������8��
D.����ʽΪC7H16���������̼������5��̼ԭ�ӵ�ͬ���칹�干��5��(���������칹)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮMgBr2������������ʵ���Ҳ���þм��Һ��Ϊԭ���Ʊ���ˮMgBr2,װ����ͼ��ʾ(�г�װ��ʡ��)��
��֪:��Mg��Br2���ҷ�Ӧ���ų���������; MgBr2 ����ǿ��ˮ��;
��MgBr2 + 3C2H5OC2H5![]() MgBr2��3C2H5OC2H5��
MgBr2��3C2H5OC2H5��

ʵ����Ҫ��������:
����1:������ƿ��װ��10 gþм(þ����ĥ���������)��
150 mL��ˮ����;����B�м���15 mLҺ�壬����װ��;��
����2:��ֹˮ�У�����ͨ�˸���ĵ�����ֱ������ȫ����������ƿ��;
����3:��Ӧ��Ϻ�ָ������£����˳�ȥþ����Һת������һ�������ƿ�У���ȴ��0��C������.���壬���˵������Ѻ��廯þ�ֲ�Ʒ;
����4:�ñ�ϴ�Ӵֲ�Ʒ����ѹ���ˣ��������Ѻ��廯þ�����������1609��C�ֽ����ˮMgBr2��
�ش���������:
��1��MgBr2 ���γɹ��̿��õ���ʽ��ʾΪ_____________
��2������A��������_______;����B��������___________.ʵ��ǰ����A��B��������ƿ�ڱھ��豣�ָ��ԭ����__________________
��3��ʵ����,______________(������������������)�ø������������ﵪ��,������___________��
��4����ȥ����ˮԡ��������ƿ������MgBr2��ͬʱ�����ܻ�������������X, 1 mol X��50 mol e-,�仯ѧʽΪ______________________________________________��
��5������4���ü�ѹ����(����������ѹǿ��ʹ��Һ���ٷ���)������װ�ÿ�������ѹ���˵���________________________(�����)��

��6��Ϊ�ⶨ��Ʒ�Ĵ���(�ٶ����ʲ����뷴Ӧ)������EDTA (��дΪY4-����ɫ)����Һ�ζ��������TΪָʾ��(pH=6.3~11.6ʱ����ɫ,pH>11.6ʱ�Գ�ɫ)����֪: Mg2+�����T�γɵ������(Mg2+_���T)�ʾƺ�ɫ��Mg2+��Y4-�γɵ�MgY2-Ϊ��ɫ;��pHԼΪ9�Ļ�����Һ�еζ�����Ӧ�����ӷ���ʽ�ɼ�ʾΪ: Mg2+ + Y4-=MgY2-, Mg2+-��� T+Y4- =MgY2- +���T��
���жϵζ��յ������Ϊ__________________.
�ڲⶨǰ���ȳ�ȡ0.2500g��ˮMgBr2��Ʒ���ܽ����2�����T��Һ��ָʾ������0. 0500 mol��L-1 EDTA����Һ�ζ����յ㣬�ظ����εζ���ƽ������EDTA����Һ26. 60 mL,������ˮMgBr2��Ʒ�Ĵ�����___________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ�ɷ�ΪAl2O3�������������ʣ�����ȡ���Ĺ������̼��������£�
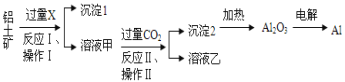
�Իش��������⣺
��1���Լ�XΪ__________��
��2��д���Լ�X�ܽ�Al2O3�Ļ�ѧ����ʽ________
��3�������������Ϊ_________����������ƣ���
��4��������������������ڸ����£��ᷢ�����ҵķ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ_______��
��5����Ӧ������ӷ���ʽΪ______��
��6�����������������ȡ������������0.6 mol���ӷ���ת�ƣ��������ܵõ���������������________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��Ļ�ѧŵ�����������Ϊ﮵���о�����������λ��ѧ�ҡ������ֳ���﮵�أ�һ���Dz������������Li(NiCoMn)O2�����������Ϊ����������Ԫ����﮵��������һ���Dz����������Ϊ������������﮵�ء���ش��������⣺
(1)��̬��ԭ�ӵļ۵����Ų�ʽΪ____��Mnλ��Ԫ�����ڱ���____ ��(����s������p������d������ds������f��)��
(2)��Ԫ�ؿ����γɶ��ֺ�����H3PO4��H3PO2��H3PO3��HPO3������������������ǿ����___��PO43-�Ŀռ乹���� ___������ԭ�ӵ��ӻ���ʽ�� ____��
(3)CoO��MnO������������۵��ɸߵ��͵�˳���� ___��ԭ���� ___��
(4)PH3��____����(���������������Ǽ�����)������ˮ�е��ܽ��Ա�NH3С��ԭ���� _____
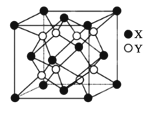
(5)���Li2S(Ħ������Mgmol-1)���������ǿ����Ƚ�﮵�صĹؼ����ϣ���﮵ľ���Ϊ��өʯ�ṹ���侧���ṹ��ͼ������﮾�����ܶ�Ϊag.cm-3����������������S2-�ľ�����___nm��(�ú�a��M��NA�ļ���ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ������з��ĶԶ��ױ���ɫ�ϳ���Ŀȡ���½�չ����ϳɹ�����ͼ��ʾ��

����˵������ȷ����
A. �����ϩ����̼ԭ�ӿ��ܹ�ƽ��
B. ������ˮ����M�ͶԶ��ױ�
C. �Զ��ױ���һ�ȴ�����2��
D. M��ij��ͬ���칹�庬�б����������Ʒ�Ӧ�ų�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com